
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция. Изотерма адсорбции. Уравнение Гиббса.
ПН растворов обычно отличается от ПН растворителя. Растворенное вещество может не изменять Поверхностная свободная энергия стремится к минимуму, поэтому при повышении Под влиянием этих двух факторов устанавливается равновесие, в результате которого концентрация вещества в поверхностном слое уменьшается по сравнению с концентрацией в объеме. Если растворенное вещество снижает Самопроизвольное изменение концентрации вещества в поверхностном слое, отнесенное к единице поверхности, называется адсорбцией, обозначается через Г и выражается в кмоль/м2, или моль/см2. Если Г>0 адсорбцию называют положительной, если Г<0 - отрицательной. Если растворенное вещество не изменяет Простое термодинамическое соотношение между поверхностной концентрацией Г и изменением ПН с активной концентрацией растворяемого вещества
где
Для разбавленных растворов активность заменяют концентрацией С:
Из уравнения следует, что только те вещества показывают положительную адсорбцию, с повышением концентрации которых ПН понижается, Если Вещества, повышающие ПН, называются отрицательно поверхностно-активными веществами (инактивными, ими являются неорганические соли). Вещества, понижающие ПН называют поверхностно-активными (ПАВ) (см. стр. 98-102). К ПАВ относятся органические вещества, молекулы которых построены из участков с резко различающимися свойствами. Одна часть молекулы полярная, другая – неполярная (углеводородный радикал). Полярная: -OH, -COOH, -SO3Na, -SO3H, -NH2, -SO2H. Полярная часть гидрофильна, неполярная – гидрофобна. ПАВ характеризуются величиной ГЛБ (гидрофильно-липофильного баланса).
Величина В гомологическом ряду жирных кислот, спиртов и аминов понижение Согласно правилу Дюкло-Траубе, при удлинении цепи на группу СН2 поверхностная активность Для определения этой характеристики строят зависимость
Построение изотермы адсорбции и нахождение величин Изотерма адсорбции описывается уравнением Ленгмюра:
где ванного на 1 м2 поверхности, кмоль/м2;
Зная Г можно рассчитать площадь S, приходящуюся на 1 молекулу. Число адсорбированных молекул на 1 м2 составляет:
Отсюда:
С увеличением Г величина S уменьшается и при
Пользуясь
Строят изотерму ПН (зависимость По изотерме ПН рассчитывают Г по уравнению Гиббса. Для этого к кривой
Рис. 6.5. Построение изотермы адсорбции по изотерме поверхностного натяжения.
Каждой концентрации С соответствует отрезок Z на оси ординат. Длина отрезка, выраженная в единицах ПН равна: Подставив полученные значения Z в уравнение:
получим:
Используя Z для ряда концентраций, рассчитывают адсорбцию Г. Строят изотерму адсорбции, откладывая по оси абсцисс С, а по оси ординат Г. Где сложно провести касательную (в интервале концентраций 0,2-0,15 моль/л) рассчитывают изменение:
Данные заносят в таблицу:
Значение
Рис. 6.6. График уравнения Ленгмюра в прямолинейных координатах.
Угол Отрезок Из этого уравнения определяем Из уравнения
Лекция 7. Поверхностные явления. Адсорбция
Основные определения. Изотерма адсорбции. Причины адсорбции. Теории адсорбции. Частные случаи адсорбции.
Одним из основных поверхностных явлений в коллоидных системах, обладающих поверхностью, является адсорбция. С адсорбцией связаны коагуляция, пептизация, изменение знака заряда частиц и другие явления. Адсорбцией называется концентрирование газообразного или растворенного вещества на поверхности раздела фаз. Различают понятия: сорбция, адсорбция, абсорбция. Сорбция - поглощение каким-либо веществом других веществ. Адсорбция - протекание процесса сорбции только на поверхности, увеличивается концентрация вещества на границе раздела фаз. Абсорбция - поглощение вещества всем объемом другого вещества. При абсорбции поглощаемое вещество диффундирует вглубь абсорбента Вещество, на поверхности которого идет адсорбция, называется адсорбентом, т.е. адсорбент - это вещество, адсорбирующее другое вещество. Вещество, которое адсорбируется, называется адсорбтивом или адсорбатом. Адсорбция Г выражается количеством адсорбтива (адсорбата) в молях, адсорбировавшегося на поверхности адсорбента, площадью 1 м2: Для определения адсорбции необходимо найти экспериментально давление газа или количество адсорбтива в объеме, в котором происходит адсорбция, до и после адсорбции. Чаще всего адсорбцию определяют по привесу адсорбента. Общую термодинамическую теорию адсорбции разработал в конце XIX века Гиббс. В XX веке адсорбцию исследовали: Лэнгмюр, Поляни, Брунауэр, Гурович, Шилов, Дубинин и др. Различают адсорбцию физическую и химическую. Физическая адсорбция обеспечивается силами Ван-дер-Ваальса, протекает самопроизвольно, молекулы адсорбтива могут перемещаться по поверхности (нелокализованная адсорбция), характеризуется обратимостью, отсутствием стехиометрических соотношений, уменьшением адсорбции при повышении температуры, сопровождается десорбцией. Процессы адсорбции и десорбции находятся в равновесии: адсорбция «десорбция. Химическая адсорбция или хемосорбция обусловлена химическим взаимодействием адсорбента с адсорбтивом. Молекулы адсорбтива не могут перемещаться по поверхности адсорбента. Необратима. Тепловой эффект близок к энергии образования химических соединений. Повышение температуры способствует хемосорбции. Адсорбцию чаще всего характеризуют зависимостью количества адсорбируемого вещества а от концентрации или давления На изотерме можно выделить три участка: 1-й - адсорбция пропорциональна концентрации вещества; 3-й участок - поверхность насыщена адсорбтивом; 2-й участок - промежуточное состояние.
Изотерма адсорбции по виду напоминает параболу.
Рис. 7.1. Изотермы адсорбции. Для аналитического выражения изотермы, Фрейндлих предложил эмпирическое уравнение вида:
где К и п - константы.
Для сорбции твердого вещества из раствора:
где с - равновесная концентрация; п находится в пределах 0,1 - 0,5 и характеризует степень приближения изотермы к прямой.
Физический смысл константы К становится ясным, если принять с= 1. Тогда К представляет собой величину адсорбции при равновесной концентрации адсорбтива, равной 1 моль/л. Адсорбция обусловлена разными причинами. Физическая сорбция осуществляется за счет сил Ван-дер-Ваальса между электронейтральными молекулами (1-10 кДж/моль). Различают полярные и неполярные силы Ван-дер-Ваальса, проявление которых зависит от полярности молекул. Полярные силы делят на электростатические и индукционные. К электростатическим относят силы, возникающие между молекулами, имеющими постоянный дипольный момент. Индукционные силы также имеют электростатическую природу, но возникают между молекулой, имеющей постоянный дипольный момент, и неполярной молекулой, в которой индуцируется дипольный момент под действием первой полярной молекулы. Неполярные (дисперсионные) силы возникают между неполярными молекулами и имеют сложную квантовомеханическую природу. Происхождение этих сил следующее: в неполярной молекуле можно выделить один электрон и рассмотреть его движение относительно ядер. Вследствие того, что электрон движется на некотором расстоянии от ядер, в молекуле в каждый момент времени возникает диполь, индуцирующий диполь в соседней молекуле. Все виды Ван-дер-Ваальсового взаимодействия убывают пропорционально расстоянию между молекулами в шестой степени, т.е. для них характерен закон " Чаще всего возникают все виды Ван-дер-Ваальсового взаимодействия одновременно, но с разной долей участия каждого вида. Вклад каждого из взаимодействий оценить сложно. Но качественно можно оценить виды сорбционного взаимодействия, зная строение адсорбента и адсорбтива. Причиной адсорбции, близкой к физической, может быть также образование водородной связи. Атом водорода имеет значительно меньшие размеры, чем другие атомы и поэтому его ядро может подходить особенно близко к неподеленным парам электронов других атомов.
С этим связаны два важных свойства атома водорода. Первое свойство заключается в большой подвижности водорода связанного с электроотрицательными атомами, имеющими неподеленную пару электронов (группа азота, кислорода, фтора). Связанный с этими атомами водород очень мало экранирован и к нему близко может подойти другой электроотрицательный атом, имеющий активную неподеленную пару электронов. Энергия электростатического притяжения между ними оказывается соизмеримой с энергией прежней связи. Второе свойство заключается в том, что при сближении двух молекул до расстояния, допускающего переход протона, последний притягивается к обеим атомам и удерживает один ковалентной, а другой водородной связью, причем, между ними может происходить перемещение по схеме:
Вследствие этого, водородную связь рассматривают как донорно-акцепторную или как промежуточный тип связи между химической и физической связями. Водородная связь невелика — 2-10 ккал/моль, но играет эта связь чрезвычайно важную роль, так как суммарно может равняться химической. Например, в полиуретанах, где суммарно величина водородных связей может составлять 100 -200 ккал/моль. Водородную связь обеспечивают группы:
В качестве донора электронов может выступать p-электронное облако двойных алифатических связей >С=С< или ароматической системы:
Вода удерживается на поверхностях за счет водородной связи. Гидроксилированная поверхность силикагеля удерживает воду по схеме:
При адсорбции полимера, например, из водных растворов вода может играть роль активного конкурента полимера. Поэтому концентрация полимера должна быть значительно завышена, чтобы обеспечить его преимущественную сорбцию. Водородную связь обнаруживают с помощью ИК-спектров. Различают адсорбцию на поверхности раздела следующих фаз: 1) газ - твердое тело; 2) газ - раствор; 3) твердое тело - раствор; 4) адсорбция на поверхности двух несмешивающихся жидкостей (жидкость - раствор).
Теории адсорбции. Теория мономолекулярной адсорбции. Лэнгмюр - американский физико-химик, 1915г.) В теории Лэнгмюра исходят из следующих положений: 1. Адсорбция является локализованной и обеспечивается силами, близкими к химическим, таковыми Лэнгмюр считал все силы, обеспечивающие когезионную прочность вещества. 2. Адсорбция протекает на активных центрах поверхности. 3. В результате адсорбции образуется мономолекулярный слой адсорбтива на поверхности. 4. Адсорбция сопровождается десорбцией, т.е. молекулы могут через время отрываться от поверхности. Их место занимают новые молекулы. Время пребывания молекул адсорбтива в адсорбированном состоянии зависит от температуры. Процесс адсорбции представляется как образование адсорбционного комплекса между адсорбентом и адсорбтивом: адсорбтив + адсорбент «адсорбционный
Комплекс Исходя из приведенных положений Лэнгмюр получил уравнение адсорбции, которое имеет вид:
где
Для сорбции газов и паров, уравнение Лэнгмюра имеет вид:
 Типичный вид изотермы адсорбции Лэнгмюра показан на рис. 7.2. Типичный вид изотермы адсорбции Лэнгмюра показан на рис. 7.2.
Рис. 7.2. Изотерма адсорбции Лэнгмюра.
Уравнение Лэнгмюра преобразуется в уравнение прямой:
Такая зависимость позволяет графически определить оба постоянных параметра адсорбционной изотермы. На рис. 7.3 представлена типичная изотерма адсорбции в линейных координатах. Экстраполяция зависимости до оси ординат дает отрезок равный
Рис. 7.3. Изотерма адсорбции Лэнгмюра в прямолинейных координатах.
Изотерма адсорбции может иметь ступенчатый вид:
Рис. 7.4. Изотерма ступенчатой адсорбции
Изотерма адсорбции Фрейндлиха (1880-1941гг., немецкий физико-химик). Представления Лэнгмюра идеализируют и упрощают действительную картину адсорбции. В действительности поверхность большинства адсорбентов неоднородна и адсорбция не ограничивается образованием мономолекулярного слоя, вследствие чего уравнение адсорбции усложняется. Фрейндлих предположил, что адсорбция зависит от давления и концентрации и предложил эмпирическое уравнение, которое имеет вид степенной функции:
где иходящаяся на 1 г адсорбирующего материала, г.;
В логарифмической форме уравнение имеет вид:
т.е. сорбция выражается линейной зависимостью. Наклон прямой прямо пропорционален Позже Зельдович теоретически вывел уравнение, эмпирически предложенное Фрейндлихом.
Рис. 7.5. Изотермы адсорбции Фрейндлиха. Полимолекулярная сорбция На практике часто встречаются изотермы, имеющие вид:
Такой вид изотерм свидетельствует о том, что связывание адсорбтива адсорбентом не прекращается после образования мономолекулярного слоя, т.е. свидетельствует о полимолекулярной сорбции. Теорию полимолекулярной адсорбции предложил Поляни (1915 г). Исходные положения этой теории: 1. Адсорбция обусловлена чисто физическими силами. 2. На поверхности адсорбента нет активных центров. Адсорбционные силы действуют вблизи от поверхности и образуют около этой поверхности непрерывное силовое поле. 3. Адсорбционные силы действуют на сравнительно большие расстояния, благодаря чему образуется у поверхности адсорбента адсорбционный объем. 4. Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю. 5. Притяжение молекулы адсорбтива поверхностью не зависит от наличия в адсорбционном, пространстве других молекул. 6. Адсорбционные силы не зависят от температуры, т.е. с изменением температуры адсорбционный объем не изменяется. Силовое поле у поверхности по этой теории сравнивают с гравитационным полем.
Рис. 7.7. Схема адсорбционного объема.
В зависимости от условий адсорбции и природы адсорбента и адсорбтива применима теория Ленгмюра или Поляни. Обобщенная теория была развита Брунауэром, Эмметом и Теллером (1935-1940 г.). Их теория получила название БЭТ. Основные положения теории БЭТ: 1. На поверхности адсорбента имеется определенное количество равноценных в энергетическом отношении центров, способных удерживать молекулы адсорбтива. 2. Допускается, что взаимодействие между соседними адсорбированными молекулами отсутствует. 3. Каждая молекула первого слоя является активным центром для адсорбции и образования второго адсорбционного слоя, и т.д. 4. Предполагается, что все молекулы во втором и более далеких слоях имеют такую же сумму статических состояний как в жидком состоянии, которое отличается от суммы состояний первого слоя.
Рис. 7.8. Схема полимолекулярной адсорбции, принятая по теории БЭТ.
На основе этих представлений Брунауэр, Эммет и Теллер предложили уравнение изотермы адсорбции паров:
где
С - константа равновесия полимолекулярной сорбции.
При По мере приближения Уравнение БЭТ легко приводится к линейной форме:
По наклону прямой и отсекаемому на оси ординат отрезку находят
Частные случаи адсорбции.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 3633; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.150.163 (0.143 с.) |
 , повышать и понижать его.
, повышать и понижать его. вещество будет удаляться с поверхности внутрь жидкости. Полному удалению молекул растворенного вещества с поверхности препятствует тепловое движение, под действием которого вещество стремится к равномерному распределению в объеме.
вещество будет удаляться с поверхности внутрь жидкости. Полному удалению молекул растворенного вещества с поверхности препятствует тепловое движение, под действием которого вещество стремится к равномерному распределению в объеме. , то концентрация его в поверхностном слое увеличивается.
, то концентрация его в поверхностном слое увеличивается.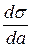 было выведено Гиббсом:
было выведено Гиббсом:
 - активность раствора;
- активность раствора;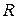 - универсальная газовая постоянная;
- универсальная газовая постоянная; - абсолютная температура.
- абсолютная температура.
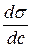 <0.
<0. , согласно Ребиндеру, является мерой способности вещества понижать поверхностную энергию, она называется поверхностной активностью и обозначается
, согласно Ребиндеру, является мерой способности вещества понижать поверхностную энергию, она называется поверхностной активностью и обозначается 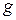 . Ее размерность – Н/м.
. Ее размерность – Н/м. . Используя уравнение Гиббса, строят зависимость
. Используя уравнение Гиббса, строят зависимость  .
. .
.
 – предельная концентрация вещества, адсорбиро-
– предельная концентрация вещества, адсорбиро- - константа равновесия, равная отношению констант скоростей процессов десорбции и адсорбции.
- константа равновесия, равная отношению констант скоростей процессов десорбции и адсорбции.

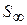 :
:
 насыщенного поверхностного слоя:
насыщенного поверхностного слоя: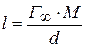
 - молекулярная масса;
- молекулярная масса; - плотность адсорбированного вещества.
- плотность адсорбированного вещества. или
или  . Находят несколько значений
. Находят несколько значений  для C1, C2, C3,…и строят зависимость
для C1, C2, C3,…и строят зависимость 
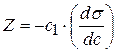 , так как согласно построению
, так как согласно построению  .
.
 и
и  и определяют
и определяют 






 на рис. 6.6 позволяет определить
на рис. 6.6 позволяет определить  .
. .
. вычисляем
вычисляем  из уравнения
из уравнения  .
. (моль/м2) или
(моль/м2) или  (моль/кг) - если площадь трудно рассчитать.
(моль/кг) - если площадь трудно рассчитать. при Т = соnst. Эти зависимости называются изотермами адсорбции.
при Т = соnst. Эти зависимости называются изотермами адсорбции.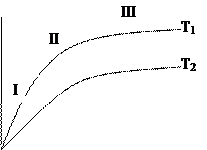


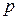 - равновесное давление газа в системе;
- равновесное давление газа в системе;
 ".
".



 (гиперболическая функция)
(гиперболическая функция) - величина адсорбции;
- величина адсорбции; .
.


 , а тангенс угла наклона прямой равен
, а тангенс угла наклона прямой равен  .
.



 или
или  ,
, - масса адсорбированного вещества, п
- масса адсорбированного вещества, п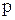 - давление;
- давление; - концентрация;
- концентрация; и
и 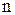 - константы, которые не имеют физического смысла и играют роль подгоночных коэффициентов. Для большинства случаев
- константы, которые не имеют физического смысла и играют роль подгоночных коэффициентов. Для большинства случаев  .
. ,
, .
.





 - давление насыщенного пара при данной температуре;
- давление насыщенного пара при данной температуре; - относительное давление пара;
- относительное давление пара; происходит объемная конденсация пара.
происходит объемная конденсация пара.
 и
и  . Найдя
. Найдя  , где
, где  - площадь, занимаемая одной молекулой;
- площадь, занимаемая одной молекулой; 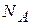 - число Авогадро.
- число Авогадро. найденное с помощью теории БЭТ, совпадают со значениями, полученными неадсорбционными методами, что свидетельствует о правильности теории БЭТ.
найденное с помощью теории БЭТ, совпадают со значениями, полученными неадсорбционными методами, что свидетельствует о правильности теории БЭТ.


