
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные физические величины и законыСтр 1 из 2Следующая ⇒
Варианты контрольной работы «Молекулярная физика и термодинамика»
Задачи
1. Сосуд емкостью 2. Два сосуда одинаковой емкости содержат кислород. В одном сосуде давление 3. Баллон емкостью 4. Определить массу m 1одной молекулы сероуглерода CS2. Принимая, что молекулы в жидкости имеют шарообразную форму и расположены вплотную друг к другу, определить диаметр d молекулы. 5. Найти плотность ρ газовой смеси, состоящей по массе из одной части водорода и восьми частей кислорода при давлении 6. В баллоне емкостью 7. В баллоне емкостью 8. Вычислить плотность ρ кислорода, находящегося в баллоне под давлением 9. Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением 10. Баллон емкостью 11. В азоте взвешены мельчайшие пылинки, которые движутся так, как если бы они были очень крупными молекулами. Масса каждой пылинки
12. Удельные теплоемкости некоторого газа: 13. Баллон емкостью 14. Найти среднюю квадратичную скорость молекул газа, плотность которого при давлении 750 мм рт. ст. равна 15. Найти диаметр d молекул водорода, если для водорода при нормальных условиях длина свободного пробега молекул 16. Газ занимает объем 17. Некоторый газ находится при температуре 18. Определить среднее число соударений 19. Сосуд емкостью 20. Вычислить теплоемкость при постоянном объеме двухатомного газа, заключенного в сосуд 21. В закрытом сосуде объемом 10 л находится воздух при давлении 22. При изотермическом расширении одного моля водорода, имевшего температуру 23. В цилиндре под поршнем находится азот массой 24. При адиабатическом сжатии кислорода массой 25. Азот находится в закрытом сосуде объемом 3 л при температуре 27 °С и давлении
26. При изотермическом расширении водорода массой 27. Из баллона, содержащего водород под давлением 28. При изотермическом расширении 2 м3 газа давление его меняется от 29. Гелий находится в закрытом сосуде объемом 2 л при температуре 20 °С и давлении 30. Для нагревания некоторой массы газа на 50 °С при постоянном давлении необходимо затратить 160 кал. Если эту же массу газа охладить на 100 °С при постоянном объеме, то выделяется 240 кал. Какое число степеней свободы имеют молекулы этого газа? 31. Газ совершает цикл Карно. Работа изотермического расширения газа 32. Совершая цикл Карно, газ отдал охладителю теплоту 33. Газ совершает цикл Карно. Абсолютная температура охладителя 34. Газ совершает цикл Карно. Температура нагревателя 35. Совершая цикл Карно, газ получил от нагревателя теплоту 36. Газ, совершающий цикл Карно, получает от нагревателя теплоту 37. Совершая цикл Карно, газ отдал охладителю 2/3 теплоты, полученной от нагревателя. Определить температуру охладителя, если температура нагревателя 38. Газ совершает цикл Карно. Температура охладителя 39. Идеальная тепловая машина, работающая по циклу Карно, получает за каждый цикл от нагревателя 600 кал. Температура нагревателя 400 К, температура охладителя 300 К. Найти работу, совершаемую машиной за один цикл, и количество теплоты, отдаваемое охладителю за один цикл. 40. Идеальная тепловая машина работает по циклу Карно. При этом 80 % тепла, получаемого от нагревателя, передается охладителю. Количество теплоты, получаемое от нагревателя, равно 1,5 ккал. Найти: 1) кпд цикла; 2) работу, совершенную при полном цикле.
СПРАВОЧНЫЕ ТАБЛИЦЫ Таблица П.1 Продолжение приложения Таблица П.3 Плотность твердых тел
Таблица П4 Плотность жидкостей
Таблица П.5 Продолжение приложения Таблица П.8 Показатель преломления
Таблица П.9 Работа выхода электронов
Таблица П.10 Относительные атомные массы (атомные веса) А
Продолжение приложения Окончание табл. П.10
Таблица П.11 Продолжение приложения Таблица П.12 Внесистемные единицы
Продолжение приложения Продолжение табл. П.14
Продолжение приложения
Окончание табл. П.14
Примечания: 1. В табл. 14 не включены кратные и дольные единицы, так как все они получаются одинаково путем добавления соответствующих приставок. Например: 1 мегаэлектрон-вольт (МэВ) = 106 эВ; 1микрометр (мкм) = 10–6 м; 1 наноньютон (нН) = 10–9 Н. 2. Электрическая и магнитные постоянные имеют следующие значения в единицах СИ: · электрическая постоянная · магнитная постоянная
Окончание приложения Таблица П.15 Приставки и множители для образования десятичных
Варианты контрольной работы «Молекулярная физика и термодинамика»
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ И ЗАКОНЫ
Уравнение состояния идеального газа (уравнение Менделеева–Клапейрона)
где Для однородного газа
где Для смеси газов
Парциальное давление
Основное уравнение молекулярно-кинетической теории идеальных газов
где Средняя кинетическая энергия молекулы
где Средняя скорость молекул
Средняя квадратичная скорость молекул
Средняя длина свободного пробега молекул
где Внутренняя энергия идеального газа
Работа, совершаемая газом при изменении объема от
Работа газа в изопроцессах: – изохорный – изобарный – изотермический Теплота, полученная (отданная) газом,
где Первое начало термодинамики
где Удельная теплоемкость газа при постоянном объеме
Удельная теплоемкость газа при постоянном давлении
Уравнение адиабатического (
где Работа газа при адиабатическом процессе
Коэффициент полезного действия тепловой машины
где Коэффициент полезного действия цикла Карно (идеальной тепловой машины)
где Пример 1. Один баллон емкостью Дано: Найти: Решение. Парциальное давление азота
В начальных состояниях уравнения Менделеева–Клапейрона для азота и кислорода есть
Учитывая формулы (2.2), уравнения (2.1) принимают вид:
Получаем
Подставим заданные численные значения
Полное давление смеси газов равно сумме парциальных
Пример 2. Определить среднюю кинетическую энергию Дано: Найти: Решение. Средняя кинетическая энергия вращательного движения молекулы
где Суммарная кинетическая энергия всех молекул газа (внутренняя энергия идеального газа)
где Отсюда
Подставляя формулу (2.5) в уравнение (2.3), получим
Учитывая, что
Подставим численные значения величин, учитывая, что для двухатомного газа
Пример 3. Определить среднюю длину свободного пробега < Дано: Найти: Решение. Средняя длина свободного пробега молекул определяется формулой
где Из уравнения Менделеева–Клапейрона в виде
где Перепишем уравнение (2.6) с учетом формулы (2.7)
Подставим численные значения
Среднее число столкновений атомов за единицу времени можно найти из формулы
Средняя скорость
Таким образом,
Подставим численные значения
Пример 4. Кислород массой Дано:
Найти: Решение. Изменение внутренней энергии газа выражается формулой
В данном случае
где i – число степеней свободы молекул газа (для двухатомных молекул кислорода i = 5). Температуры газа в каждом состоянии найдем, используя уравнение Менделеева–Клапейрона
Отсюда
Подставим численные значения параметров каждого из трех состояний
Подставляя в выражение (2.8) числовые значения, находим
Работа расширения газа при постоянном давлении выражается формулой
Работа газа при
Таким образом, полная работа, совершаемая газом

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.222.47 (0.329 с.) |
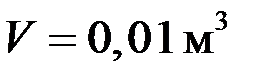 содержит азот массой
содержит азот массой  и водород массой
и водород массой  при температуре
при температуре  . Определить давление
. Определить давление  смеси газов.
смеси газов.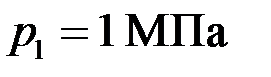 и температура
и температура 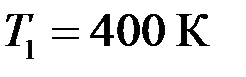 , в другом
, в другом  ,
,  . Сосуды соединили трубкой и охладили находящийся в них кислород до температуры
. Сосуды соединили трубкой и охладили находящийся в них кислород до температуры  . Определить установившееся давление
. Определить установившееся давление  в сосудах.
в сосудах. содержит смесь водорода и азота при температуре
содержит смесь водорода и азота при температуре  и давлении
и давлении 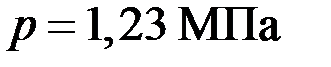 . Масса смеси
. Масса смеси  . Определить массу m 1 водорода и массу m 2 азота.
. Определить массу m 1 водорода и массу m 2 азота. и температуре
и температуре  .
. находится аргон под давлением
находится аргон под давлением  и температуре
и температуре  . Когда из баллона было взято некоторое количество аргона, давление в баллоне понизилось до
. Когда из баллона было взято некоторое количество аргона, давление в баллоне понизилось до  , а температура установилась
, а температура установилась  . Определить массу т аргона, взятого из баллона.
. Определить массу т аргона, взятого из баллона. находится водород при нормальных условиях. После того как в баллон было дополнительно введено некоторое количество гелия, давление в баллоне возросло до
находится водород при нормальных условиях. После того как в баллон было дополнительно введено некоторое количество гелия, давление в баллоне возросло до  , а температура не изменилась. Определить массу гелия, введенного в баллон.
, а температура не изменилась. Определить массу гелия, введенного в баллон. при температуре
при температуре  .
.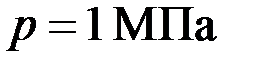 . Считая, что масса кислорода составляет 20 % от массы смеси, определить парциальные давления p 1 и р 2 отдельных газов.
. Считая, что масса кислорода составляет 20 % от массы смеси, определить парциальные давления p 1 и р 2 отдельных газов. заполнен азотом. Температура азота
заполнен азотом. Температура азота  . Когда часть азота израсходовали, давление в баллоне понизилось на
. Когда часть азота израсходовали, давление в баллоне понизилось на  . Определить массу
. Определить массу  израсходованного азота. Процесс считать изотермическим.
израсходованного азота. Процесс считать изотермическим. . Температура газа
. Температура газа  . Определить средние квадратичные скорости
. Определить средние квадратичные скорости  , а также средние кинетические энергии
, а также средние кинетические энергии  поступательного движения молекул азота и пылинок.
поступательного движения молекул азота и пылинок. и
и  . Определить киломольные теплоемкости.
. Определить киломольные теплоемкости. содержит азот массой
содержит азот массой  . Определить среднюю длину свободного пробега молекул.
. Определить среднюю длину свободного пробега молекул. . Чему равна молярная масса этого газа, если значение плотности дано для температуры 17 °С?
. Чему равна молярная масса этого газа, если значение плотности дано для температуры 17 °С? .
. под давлением
под давлением  . Определить кинетическую энергию поступательного движения всех молекул, находящихся в данном объеме.
. Определить кинетическую энергию поступательного движения всех молекул, находящихся в данном объеме.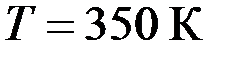 в баллоне емкостью
в баллоне емкостью  под давлением
под давлением  . Теплоемкость этого газа при постоянном объеме
. Теплоемкость этого газа при постоянном объеме  . Определить отношение теплоемкостей
. Определить отношение теплоемкостей  .
. в секунду молекулы водорода при температуре
в секунду молекулы водорода при температуре  и давлении
и давлении 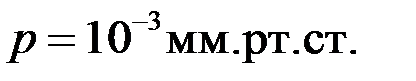
 содержит
содержит  некоторого газа под давлением
некоторого газа под давлением  . Определить среднюю квадратичную скорость молекул газа.
. Определить среднюю квадратичную скорость молекул газа. при нормальных условиях.
при нормальных условиях.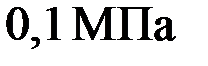 . Какое количество теплоты надо сообщить воздуху, чтобы повысить давление в сосуде в 5 раз?
. Какое количество теплоты надо сообщить воздуху, чтобы повысить давление в сосуде в 5 раз?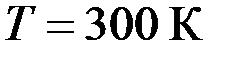 , затрачена теплота
, затрачена теплота  . Во сколько раз увеличился объем газа?
. Во сколько раз увеличился объем газа?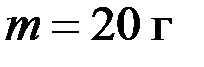 . Газ был нагрет от температуры
. Газ был нагрет от температуры  до температуры
до температуры  при постоянном давлении. Определить теплоту Q, переданную газу, совершенную газом работу А и приращение
при постоянном давлении. Определить теплоту Q, переданную газу, совершенную газом работу А и приращение  внутренней энергии.
внутренней энергии.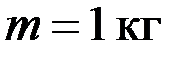 совершена работа
совершена работа  . Какова конечная температура Т 2газа, если до сжатия кислород находился при температуре
. Какова конечная температура Т 2газа, если до сжатия кислород находился при температуре  ?
? . После нагревания давление в сосуде повысилось до
. После нагревания давление в сосуде повысилось до  . Определить: 1) температуру азота после нагревания; 2) количество теплоты, сообщенное азоту.
. Определить: 1) температуру азота после нагревания; 2) количество теплоты, сообщенное азоту. объем газа V увеличился в два раза. Определить работу А расширения, совершенную газом, если температура газа
объем газа V увеличился в два раза. Определить работу А расширения, совершенную газом, если температура газа  . Определить теплоту Q, переданную при этом газу.
. Определить теплоту Q, переданную при этом газу. при температуре
при температуре  , выпустили половину находившегося в нем газа. Считая процесс адиабатическим, определить конечные температуру T 2 и давление р 2.
, выпустили половину находившегося в нем газа. Считая процесс адиабатическим, определить конечные температуру T 2 и давление р 2.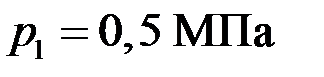 до
до  . Найти совершенную при этом работу.
. Найти совершенную при этом работу. . 1. Какое количество теплоты надо сообщить гелию, чтобы повысить его температуру на 100 °С? 2. Какова будет средняя квадратичная скорость его молекул при новой температуре? 3. Какое установится давление? 4. Какова будет плотность гелия? 5. Какова будет энергия теплового движения его молекул?
. 1. Какое количество теплоты надо сообщить гелию, чтобы повысить его температуру на 100 °С? 2. Какова будет средняя квадратичная скорость его молекул при новой температуре? 3. Какое установится давление? 4. Какова будет плотность гелия? 5. Какова будет энергия теплового движения его молекул? . Определить работу изотермического сжатия, если термический кпд цикла
. Определить работу изотермического сжатия, если термический кпд цикла  .
. . Работа цикла
. Работа цикла  . Определить температуру нагревателя, если температура охладителя
. Определить температуру нагревателя, если температура охладителя  .
. . Во сколько раз увеличится кпд цикла, если температура нагревателя повысится от
. Во сколько раз увеличится кпд цикла, если температура нагревателя повысится от 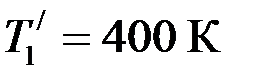 до
до  ?
? , охладителя
, охладителя 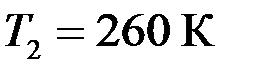 . При изотермическом расширении газ совершил работу
. При изотермическом расширении газ совершил работу  . Определить термический кпд η цикла, а также теплоту Q 2, которую газ отдает охладителю при изотермическом сжатии.
. Определить термический кпд η цикла, а также теплоту Q 2, которую газ отдает охладителю при изотермическом сжатии. и совершил работу
и совершил работу  . Температура нагревателя
. Температура нагревателя  . Определить температуру T 2 охладителя.
. Определить температуру T 2 охладителя. . Какую работу совершает газ, если абсолютная температура Т 1нагревателя в три раза выше, чем температура T 2 охладителя?
. Какую работу совершает газ, если абсолютная температура Т 1нагревателя в три раза выше, чем температура T 2 охладителя? .
. . Какова температура нагревателя, если за счет каждой килокалории теплоты, полученной от нагревателя, газ совершает работу
. Какова температура нагревателя, если за счет каждой килокалории теплоты, полученной от нагревателя, газ совершает работу  ?
? ;
; где с – скорость света в вакууме.
где с – скорость света в вакууме. ,
, – давление газа,
– давление газа,  ;
;  – объем занимаемый газом, м3;
– объем занимаемый газом, м3;  – количество молей газа;
– количество молей газа;  – универсальная постоянная,
– универсальная постоянная,  ;
;  – абсолютная температура газа,
– абсолютная температура газа,  .
. ,
, – масса газа, кг;
– масса газа, кг;  – масса моля (молярная масса) газа,
– масса моля (молярная масса) газа,  .
. .
. i -й компоненты смеси газов находят из
i -й компоненты смеси газов находят из .
. ,
, – концентрация молекул,
– концентрация молекул,  ;
;  – общее число молекул газа;
– общее число молекул газа;  – масса одной молекулы, кг;
– масса одной молекулы, кг;  – средний квадрат скоростей молекул,
– средний квадрат скоростей молекул,  ;
;  – объем, занимаемый газом, м3.
– объем, занимаемый газом, м3.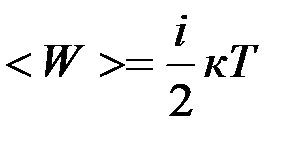 ,
,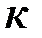 – постоянная Больцмана,
– постоянная Больцмана,  ;
;  – число Авогадро (число молекул в одном моле);
– число Авогадро (число молекул в одном моле);  – число степеней свободы молекул (одноатомный газ:
– число степеней свободы молекул (одноатомный газ:  , двухатомные молекулы:
, двухатомные молекулы:  , многоатомные молекулы:
, многоатомные молекулы:  ).
).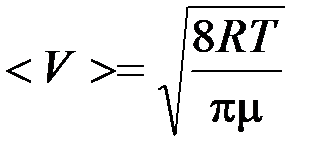 .
.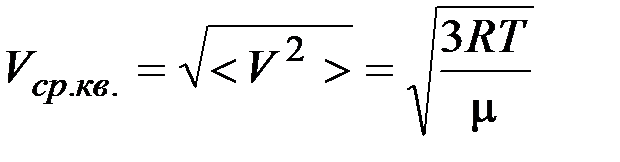 .
. ,
, – эффективный диаметр молекулы.
– эффективный диаметр молекулы. .
. до
до 
 .
. ,
,  ;
; ,
,  ;
; ,
,  .
. ,
, – удельная теплоемкость,
– удельная теплоемкость,  .
. ,
, – изменение внутренней энергии.
– изменение внутренней энергии. .
. .
. ) процесса – уравнение Пуассона
) процесса – уравнение Пуассона ,
, – показатель адиабаты.
– показатель адиабаты. ;
;  .
.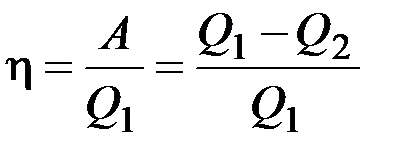 ,
, – количество теплоты, полученное системой за один цикл;
– количество теплоты, полученное системой за один цикл;  – количество теплоты, отданное системой за один цикл;
– количество теплоты, отданное системой за один цикл;  – работа, совершаемая за один цикл.
– работа, совершаемая за один цикл. ,
, – температура нагревателя;
– температура нагревателя;  – температура охладителя.
– температура охладителя. содержит азот под давлением
содержит азот под давлением  , другой баллон емкостью
, другой баллон емкостью  содержит кислород под давлением
содержит кислород под давлением  . Оба баллона были соединены между собой и оба газа смешались, образовав однородную смесь (без изменения температуры). Найти парциальные давления
. Оба баллона были соединены между собой и оба газа смешались, образовав однородную смесь (без изменения температуры). Найти парциальные давления  и
и 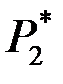 обоих газов в смеси и полное давление
обоих газов в смеси и полное давление  смеси.
смеси.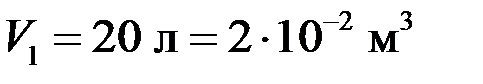 ;
;  ;
; 
 ;
;  ;
;  .
. ,
,  ,
, 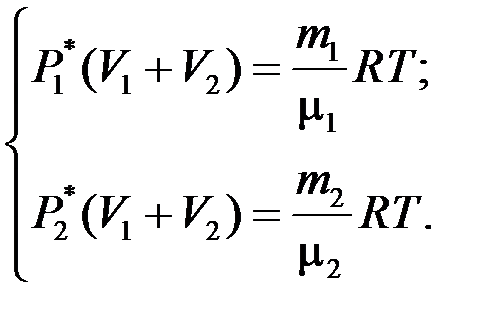
 (2.1)
(2.1) (2.2)
(2.2)
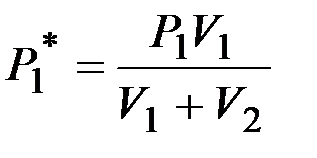 ;
;  .
. ;
; .
. ;
; .
. вращательного движения одной молекулы двухатомного газа, если суммарная кинетическая энергия молекул одного киломоля этого газа
вращательного движения одной молекулы двухатомного газа, если суммарная кинетическая энергия молекул одного киломоля этого газа  .
.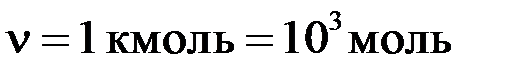 ;
;  .
. .
. . (2.3)
. (2.3) – число степеней свободы вращательного движения молекулы.
– число степеней свободы вращательного движения молекулы. , (2.4)
, (2.4) – общее число степеней свободы молекулы (поступательного и вращательного движений).
– общее число степеней свободы молекулы (поступательного и вращательного движений). . (2.5)
. (2.5) .
. , где
, где  – число Авогадро,
– число Авогадро,  , окончательно получаем
, окончательно получаем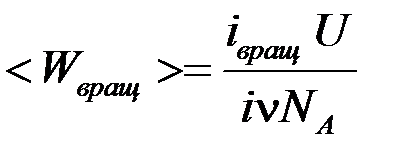 .
. ;
;  .
.
 > и среднее число столкновений
> и среднее число столкновений  молекулы гелия за 1 с при температуре
молекулы гелия за 1 с при температуре  и давлении
и давлении  .
. ;
; 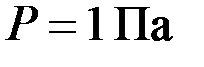 ;
;  ;
;  .
. ,
,  .
. , (2.6)
, (2.6) – эффективный диаметр молекулы. Гелий – газ одноатомный. Диаметр гелия находим из справочных таблиц;
– эффективный диаметр молекулы. Гелий – газ одноатомный. Диаметр гелия находим из справочных таблиц;  – число атомов в единице объема.
– число атомов в единице объема. T находим
T находим , (2.7)
, (2.7) – постоянная Больцмана,
– постоянная Больцмана, 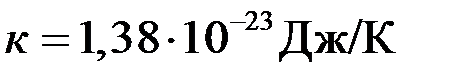 .
. .
. .
.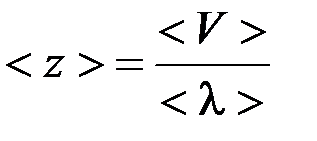 .
. – атомов определяется формулой
– атомов определяется формулой .
. .
. 1/с.
1/с. занимает объем
занимает объем  и находится под давлением
и находится под давлением  . При нагревании газ расширился при постоянном давлении до объема
. При нагревании газ расширился при постоянном давлении до объема  , а затем его давление возросло до
, а затем его давление возросло до  при неизменном объеме. Найти изменение внутренней энергии
при неизменном объеме. Найти изменение внутренней энергии  газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса. ;
;  ;
;  ;
;  ;
; ;
;  .
. ,
,  ,
, 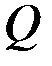 .
.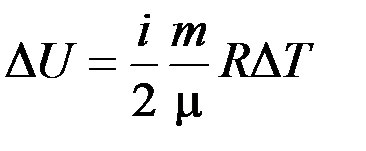 .
. .
. , (2.8)
, (2.8) .
. .
.
 ;
; .
. .
. .
. равна нулю
равна нулю .
. Рис. 4
Рис. 4



