Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пептидитрансферазний центр рибосоми
Центр є компактною структурою, яка локалізована в V домені 23SрРНК (2450-2600 н.з.) для E.coli утворює гіпотетичний круг, до складу якого входить 5 спіралізованих участків, є збагаченим модифікованими залишками. Тобто показано його локалізацію на 50S субодиниці. Сам пептидилтрансферазний центр має d- донорний і а-акцепторний сайти. Білки L2, L3, L5, L16, L17 беруть участь у його структуруванні. Ми розглянули схему утворення пептидного зв’язку (схема). Як вважають на сьогодні працює пептидильний центр рибосоми? Пептидилтрансферазний регіон “PTC-ring” розташований в V домені 23 S pРНК E.coli (2450-2600) (рис).
1) Субстрат-індуковані конформаційні зміни Ми відмітили, що на етапі утворення пептидного зв’язку відбувається нуклеофільна атака NН2 групи аміноацил-тРНК на карбонільну групу пептидил-тРНК. В разі відсутності субстрату в А-сайті рибосоми така атака може відбутись за участі молекули Н2О. Пептидилтрансферазний центр працює згідно з класичною моделлю ферментативного каталізу Кошланда – субстрат-індукованої відповідності активного центру ферменту. Отже, коли А-сайт рибосоми не зайнятий, то конформація Р-сайту рибосоми робить неможливою атаку молекули Н2О на складно-ефірний зв’язок в пептидил-тРНК. Заповнюється А-сайт, то ССА кінець аміноацил-тРНК індукує конформаційні зміни в рРНК РТС центру рибосоми. Ці зміни сприяють прийняттю оптимальних позицій α-аміногрупою у складі аа-тРНК для подальшої нуклеофільної атаки, а також вдалого розташування мішені, що атакується – карбонільної групи у складі пептидил-тРНК. Таким чином, вірна орієнтація обох субстратів є необхідною умовою наступного етапу – утворення пептидного зв’язку. 2) Функція власне каталізу Одна з доведених на сьогодні гіпотез. Реакція транспептидації проходить через етап утворення інтермедіатної сполуки з формуванням зв’язку між азотом (N) аміногрупи аміноацил-тРНК і вуглецем (С), яким пептидил приєднаний до тРНК (рис., позиція А). Атом кисню (О) у складі пептидил-тРНК набуває при цьому частково негативного заряду (рис., позиція В). Для А 2451, а саме (N1, N3), та для G 2447 ( N3), у складі 23(28)S рРНК великих субодиниць рибосом показана пряма участь в кислотно-основному каталізі. Було встановлено з використанням інгібіторного аналізу, що азот в положенні 1,3 (N1, N3) цих азотистих основ може мати перехідний протонований стан за умови захоплення протона аміногрупи, наприклад, атомом N3 аденіну, що знаходиться в активному центрі. Отже, N1 чи N3 може відібрати протон у α-NН2 групи аміноацил -тРНК та передати його на 3'-ОН-групу пептидил-тРНК, яка стає деаміноацильованою, втрачає зв'язок із вуглецем (С), замість чого остаточно формується пептидний зв'язок.
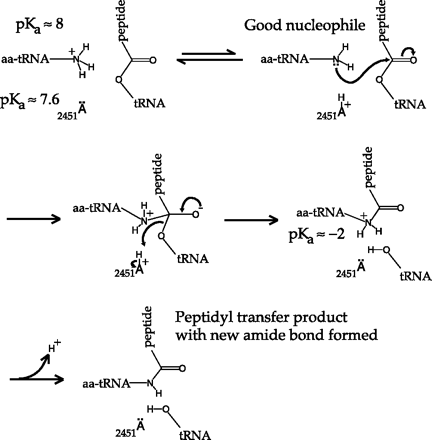
Figure AP1
Mechanism for peptide bond formation within the ribosome (peptidyl transferase activity). The aa-tRNA is present initially in its protonated form. The ribosomal base (adenosine 2451) then removes a proton from this ammonium group to generate the free amino group. The pKa values for the base and the ammonium group are expected to be nearly matched, so deprotonation should be quite feasible thermodynamically. The reaction products are the aa-tRNA with a free amino group and the protonated adenosine 2451 base. The amino group is a strong enough nucleophile to attack the ester linkage of the peptidyl-tRNA. This reaction generates a tetrahedral intermediate that collapses to release the tRNA previously linked to the polypeptide chain. The protonated adenosine 2451 can act as a general acid to facilitate this reaction. This generates the product with the new peptide bond formed, but in an N-protonated form. The pKa of this product is expected to be very low, so that it would readily give up a proton to generate the final product.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.212 (0.006 с.) |

 It highlights the central role of the rRNA, and specifically that of base A2486 (RIBOZYME!):
It highlights the central role of the rRNA, and specifically that of base A2486 (RIBOZYME!):