
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нейтрализационная коагуляцияСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Нейтрализационная коагуляция происходит при добавлении к золю неидифферентного электролита. При этом потенциалобразующие ионы связываются в малорастворимое соединение, что приводит к уменьшению по абсолютной величине термодинамического, а, следовательно, и электрокинетического потенциалов (рис. 31). Когда электрокинетический потенциал достигнет 30 мВ, начнется коагуляция и разрушение дисперсной системы. Рассмотрим в качестве примера положительный золь гидроксида железа:
При введении в золь неиндифферентного электролита КОН происходит нейтрализация потенциалопределяющих ионов Fe3+ ионами ОН– с образованием малорастворимого соединения Fe(OH)3. В результате снижается φ0-потенциал и z-потенциал, что приводит к ослаблению сил электростатического отталкивания. При снижении z до 30 мВ частицы слипаются, и происходит коагуляция. Разновидность нейтрализационной коагуляции – взаимная коагуляция, которая возникает при смешении подобных золей с противоположными знаками зарядов. Например, при смешивании положительно и отрицательно заряженных золей иодида серебра:
потенциалопределяющие ионы Ag+ и I– образуют нерастворимое соединение, что приводит к нейтрализации зарядов ядер золей. Потенциал ядра φ0 и Явление неправильных рядов Наблюдается при коагуляции золей электролитами, вызывающих нейтрализацию заряда ядра и перезарядку золя. Данное явление заключается в том, что при добавлении таких электролитов золь сначала остается устойчивым, а затем в определенном интервале концентраций электролита происходит коагуляция. При дальнейшем введении электролита золь снова становится устойчивым и, наконец, при определенной концентрации электролита снова наступает уже окончательная коагуляция золя. Например, если к золю гидроксида железа
небольшими порциями добавлять КОН, то ионы ОН– нейтрализуют потенциалопределяющие ионы Fe3+, что приводит к снижению φ0 и z-потенциала. Зависимость z-потенциала от концентрации КОН представлена на рис. После достижения изоэлектрической точки (z = 0) происходит перезарядка золя (потенциалопределяющими становятся ионы ОН–), при этом потенциал ядра и z-потенциал возрастают с обратным знаком (рис. 43).
Сопоставим зависимость скорости коагуляции от концентрации электролита с графиком z = f(СКОН) (рис.). Из рис. видно, что при ς > 30 мВ золь устойчив и скорость коагуляции равна нулю. При После перезарядки коагуляция золя продолжается до тех пор, пока Кинетика коагуляции Для начала коагуляции необходимо, чтобы частицы преодолели энергетический барьер Δ Uк и попали в первый минимум. Для этого необходимо уменьшить силы отталкивания, т.е. снизить ς-потенциал, например, за счет введения электролита. Если скорость коагуляции зависит от концентрации электролита, то идет медленная коагуляция. Потенциальный барьер исчезает при пороговой концентрации электролита. После этого скорость коагуляции не зависит от концентрации электролита, т.е. идет быстрая коагуляция. Процесс коагуляции включает две последовательные стадии: 1) диффузия (сближение частиц); 2) агрегирование (укрупнение частиц). При быстрой коагуляции каждое столкновение частиц приводит к их слипанию, поэтому скорость быстрой коагуляции определяется только диффузионной стадией. При медленной коагуляции к слипанию частиц приводят не все соударения. Скорость медленной коагуляции зависит как от диффузии частиц, так и от их взаимодействия.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 675; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.172.189 (0.008 с.) |

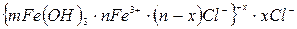 .
.


 Потенциал ядра и ς-потенциал увеличиваются до момента достижения предельной адсорбции ионов ОН– на поверхности Fe(OH)3. Затем адсорбция потенциалопределяющих ионов прекращается, потенциал ядра перестает зависеть от концентрации ионов ОН–. Дальнейшее добавление КОН приводит к увеличению концентрации индифферентных ионов К+, являющихся противоионами. В результате ДЭС сжимается и
Потенциал ядра и ς-потенциал увеличиваются до момента достижения предельной адсорбции ионов ОН– на поверхности Fe(OH)3. Затем адсорбция потенциалопределяющих ионов прекращается, потенциал ядра перестает зависеть от концентрации ионов ОН–. Дальнейшее добавление КОН приводит к увеличению концентрации индифферентных ионов К+, являющихся противоионами. В результате ДЭС сжимается и 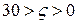 идет медленная коагуляция. Скорость коагуляции возрастает с увеличением концентрации КОН. Когда
идет медленная коагуляция. Скорость коагуляции возрастает с увеличением концентрации КОН. Когда 


