
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коагуляция гидрофобных дисперсных системСодержание книги
Поиск на нашем сайте
Коагуляция – процесс слипания частиц дисперсной фазы с образованием крупных агрегатов. Коагуляция является следствием нарушения агрегативной устойчивости лиофобных золей. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении. Разрушение коллоидной системы идет в следующей последовательности: Нарушение Нарушение агрегативной → Коагуляция → седиментационной устойчивости устойчивости Коагуляция идет самопроизвольно, так как приводит к уменьшению межфазной поверхности, а следовательно, и к снижению свободной поверхностной энергии (G пов = s S). Различают две стадии коагуляции: 1) медленная (скрытая) коагуляция: частицы укрупняются, но не теряют седиментационной устойчивости; 2) быстрая (видимая) коагуляция: частицы теряют седиментационную устойчивость, при этом, если плотность частиц больше плотности дисперсионной среды, образуется осадок. Количественной характеристикой коагуляции является скорость коагуляции. Скорость коагуляции vк – это изменение концентрации коллоидных частиц
Знак “–“ стоит перед производной, так как концентрация частиц со временем уменьшается, а скорость всегда положительна. Чтобы началась коагуляция, частицы должны преодолеть потенциальный барьер Δ Uк. Для этого необходимо уменьшить z-потенциал. Экспериментально установлено, что коагуляция начинается при |z| £ 30 мВ. Как можно уменьшить z-потенциал? 1) снизить температуру; 2) добавить электролиты. Рассмотрим механизм коагуляции гидрофобного золя электролитами. Коагуляция золей электролитами Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. При коагуляции золя электролитами различают концентрационную и нейтрализационную коагуляцию. Концентрационная коагуляция Концентрационная коагуляция происходит под действием индифферентного электролита, при этом потеря устойчивости вызывается сжатием диффузной части ДЭС при неизменном потенциале ядра (рис. 41).
Например, концентрационную коагуляцию положительного золя гидроксида железа
будет вызывать NaCl – индифферентный электролит по отношению к данному золю. Скорость коагуляции зависит от концентрации электролита (рис. 42). Зона I – зона устойчивости; при |z| ³ 30 мВ система устойчива, силы электростатического отталкивания преобладают над силами притяжения, коагуляции не наблюдается и скорость ее равна нулю.
Зона III – зона быстрой коагуляции начинается при приближении z-потенциала к 0 (изоэлектрической точке). Скорость быстрой коагуляции не зависит от концентрации электролита. Минимальная концентрация электролита, при которой начинается видимая коагуляция, называют порогом коагуляции Сп. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого противоположен заряду коллоидной частицы. Этот ион называется ионом-коагулятором. Коагуляция электролитами подчиняется нескольким эмпирическим правилам. 1. Коагулирующая способность иона-коагулятора тем больше, чем больше заряд иона(первое правило Шульце-Гарди):
где α – постоянная для данной системы величина: при z = 1 α = Сп; z – заряд иона-коагулятора. 2. При одинаковом заряде коагулирующая способность иона тем выше, чем больше его кристаллический радиус (второе правило Шульце-Гарди). В соответствии с этим правилом коагулирующая способность иона определяется его положением в лиотропном ряду (см. п. «Адсорбция электролитов»): одновалентные катионы: Li+ < Na+ < К+ < Rb+ < Cs+ двухвалентные катионы: Mg2+ < Ca2+ < Sr2+ < Ba2+
коагулирующая способность возрастает
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 252; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.144.98 (0.008 с.) |

 в единицу времени τ при постоянном объеме системы:
в единицу времени τ при постоянном объеме системы: .
.
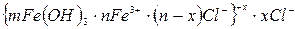
 Зона II – зона медленной коагуляции начинается при достижении z-потенциалом критического значения |z| = 30 мВ. Скорость медленной коагуляции зависит от концентрации электролита, поскольку, чем выше концентрация электролита, тем меньше z-потенциал, коагуляция идет быстрее.
Зона II – зона медленной коагуляции начинается при достижении z-потенциалом критического значения |z| = 30 мВ. Скорость медленной коагуляции зависит от концентрации электролита, поскольку, чем выше концентрация электролита, тем меньше z-потенциал, коагуляция идет быстрее. ,
, одновалентные анионы: Сl– < Br– < NQ3– < I– < CNS–.
одновалентные анионы: Сl– < Br– < NQ3– < I– < CNS–.


