
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз растворов уровень а
1. В какой последовательности при стандартных условиях из раствора будут восстанавливаться Fе2+, Cu2+, Zn2+, Ag+ с одинаковой концентрацией, если напряжение внешнего источника тока достаточно для выделения любого металла? Ответ: последовательность восстановления ионов металлов из раствора будет определяться величиной их стандартного электродного потенциала (
2. Написать последовательность процессов, протекающих на инертном аноде при электролизе раствора, содержащего следующие вещества: NaCl, Na2SO4, NaOH. Ответ: последовательность окисления анионов на инертном аноде определена в табл. 11.2. Поэтому последовательность процессов на аноде будет следующая: 1. 2Cl- – 2ē = Cl2; 2. 4ОН- – 4ē = О2 + 2Н2О. 3. анион SO 2H2O – 4е = О2 + 4H+. 3. Написать уравнение объединенного закона Фарадея для определения массы (объема) вещества, выделяющегося на электродах при электролизе. Ответ: m в =
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ УРОВЕНЬ А 1. В приведенном ряду (Cd, Zn, Ni, Ca) расставить металлы в порядке увеличения их восстановительной способности в водном растворе. Ответ: восстановительная способность металла тем выше, чем меньше величина его стандартного электродного потенциала (см. табл. 11.1). Поэтому восстановительная способность металлов будет возрастать в ряду
2. Из приведенного ряда (Cu, Ag, Mg, Ba) указать металлы, которые взаимодействуют с хлороводородной кислотой. Написать уравнения реакций. Ответ: в соответствии с рядом стандартных электродных потенциалов разбавленные кислоты (кроме HNO3) взаимодействуют только с металлами, у которых Mg + 2HCl = MgCl2 + H2. Ba + 2HCl = BaCl2 + H2. 3. Можно ли получить серебро и магний из водных растворов солей AgNO3 и Mg(NO3)2 восстановлением цинком при стандартных условиях? Написать уравнение реакции. Ответ: в соответствии с рядом стандартных электродных потенциалов металлы, у которых меньшее значение стандартных электродных потенциалов, вытесняют металлы с большим значением стандартных электродных потенциалов из водных растворов их солей. Находим стандартные электродные потенциалы (см. табл. 11.1):
, Так как Zn + 2AgNO3 = 2Ag + Zn(NO3)2. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ УРОВЕНЬ А 1. Назвать следующие комплексные соединения: K3[Fe(CN)6]; [PtCl 3(NH3)3]Cl; [Co(NO2)3(NH3)3]. Ответ: а) K3[Fe(CN)6] – гексацианоферрат (III) калия. б) [Pt(NH3)3Cl 3]Cl – хлорид трихлоротриамминплатины (IV). в) [Co(NH3)3(NO2)3] – тринитротриамминкобальт. 2. Написать формулы следующих химических соединений:
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.183.187 (0.018 с.) |
 ). Ионы металлов будут восстанавливаться в порядке уменьшения величины их стандартного электродного потенциала (см. табл. 11.1).
). Ионы металлов будут восстанавливаться в порядке уменьшения величины их стандартного электродного потенциала (см. табл. 11.1). В
В

 будет концентрироваться в анолите. На аноде будет протекать процесс
будет концентрироваться в анолите. На аноде будет протекать процесс ,
, =
=  .
. В
В
 < 0. так как (см. табл. 11.1)
< 0. так как (см. табл. 11.1)  = +0,34 В,
= +0,34 В, 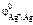 = +0,8 В,
= +0,8 В,  = –2,34 В,
= –2,34 В, 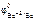 = –2,90 В, то с хлороводородной кислотой взаимодействуют только Mg и Ba.
= –2,90 В, то с хлороводородной кислотой взаимодействуют только Mg и Ba. ,
, .
. <
<  <
<  , то цинк восстанавливает серебро из раствора AgNO3, а магний из раствора Mg(NO3)2 цинком не восстанавливается:
, то цинк восстанавливает серебро из раствора AgNO3, а магний из раствора Mg(NO3)2 цинком не восстанавливается:


