
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ДE N2. Общая и неорганическая химия
Тесты по химии
ДE N2. Общая и неорганическая химия Способы выражения состава 5.1. Массовая доля гидрокарбоната натрия в растворе, полученном при смешении 50 г раствора с массовой долей NaНСO3 8% и 150 г раствора с массовой долей соли 4%, составляет ___ % (с точностью до целого значения). Введите ответ 5.2. Объем хлороводорода (н.у.), который содержится в 50 литрах 0.1 М раствора соляной кислоты, составляет ____ литра(ов) (с точностью до целого значения). Введите ответ 5.3. Массовая доля гидроксида натрия в растворе, полученном при разбавлении 200 мл 2.5М раствора NaOH в 5 раз, составляет ___ % (с точностью до целого значения; (rp-pa = 1 г/cм3). Введите ответ 5.4. Массовая доля сульфата меди (II) в растворе, полученном при растворении 50 г медного купороса (CuSO4∙5H2O) в 350 мл воды, составляет ____ % (с точностью до целого значения). Введите ответ 5.5. 50 г 49%-ного раствора серной кислоты разбавили водой до объема 500 мл. Молярная концентрация эквивалентов H2SO4 в полученном растворе составляет ____ моль/л (с точностью до целого значения). Введите ответ 5.6. Масса медного купороса, необходимого для приготовления 500 мл раствора сульфата меди (II) с массовой долей растворенного вещества 3,2% (r = 1 г/см3), составляет ____ г (с точностью до целого значения). Введите ответ 5. 7. Масса медного купороса, необходимая для приготовления 2 л 0.1 М раствора сульфата меди (II), составляет ____ г (с точностью до целого значения). Введите ответ 5.7. Масса серной кислоты, содержащейся в 1 мл раствора с молярной концентрацией эквивалентов H2SO4 равной 2 моль/л, составляет ____ мг (с точностью до целого значения). Введите ответ 5.8. Масса серной кислоты, содержащейся в 5 л раствора с молярной концентрацией эквивалентов H2SO4 равной 0.2 моль/л, составляет ____ г (с точностью до целого значения). Введите ответ 5.8. Масса кристаллогидрата (Na2CO3∙10H2O, необходимая для приготовле-ния 500 г раствора карбоната натрия с массовой долей растворенного вещества 10.6%, составляет ____ г (с точностью до целого значения). Введите ответ 5.9. Массовая доля хлорида кальция в растворе, полученном при смешении 300 г раствора с массовой долей CaCl2 15% и 200 г раствора с массовой долей 2,5%, составляет ___ % (с точностью до целого значения). Введите ответ. 5.10. Для приготовления 10 л 0.1 М раствора гидроксида натрия требуется ____ г твердой щелочи (с точностью до целого значения).
Введите ответ.
Равновесия в растворах электролитов 8.1. Формула соли, в водном растворе которой индикатор лакмус приобретает красную окраску, имеет вид … 8.2. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению H+ + OH- = H2O, имеет вид … CH3COOH + KOH →; H2SO4 + KOH →. 8.3. Сильным электролитом является раствор вещества, формула которого имеет вид … 8.4. Формула соли, значение рН водного раствора которой равно 7, имеет вид … 8.5. Соль, водный раствор которой имеет рН >7, имеет формулу … 8.6. Формула соли, водный раствор которой характеризуется рН <7, имеет вид … 8.7. Наибольшее число катионов образуется при диссоциации в воде 1 моль соли, формула которой … 8.8. Наибольшее число ионов образуется при диссоциации 1 моль соли, имею-щей формулу … 8.9. Формулы солей, водные растворы которых можно различить, используя индикатор фенолфталеин, имеют вид … 8.10. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению 2H+ + Na2CO3 + H2SiO3 →; Na2CO3 + H2SO4 →; Na2CO3 + CH3COOH →; NaHCO3 + H2SO4 →.
ДE N3. Коллоидная химия Коллоидные растворы 12.1. Диффузионный слой золя, образующегося при взаимодействии разбавлен- ного раствора сульфата меди (II) с избытком раствора гидроксида натрия, образован ионами … OH-; 12.2. При взаимодействии равных объемов 0.001 М раствора MgCl2 и 0.001 М раствора AgNO3 коллоидная частица (гранула) будет … Заряжена отрицательно; обладать переменным зарядом. 12.3. При взаимодействии равных объемов 0.002 М раствора BaCl2 и 0.001 М раствора H2SO4 потециалопределяющими будут являться ионы … 12.4. При взаимодействии равных объемов 0.002 М раствора AgNO3 и 0.001 М раствора NaCl потециалопределяющими будут являться ионы … 12.5. Ион избыточного реагента, адсорбирующийся на поверхности ядра и определяющий заряд коллоидной частицы (гранулы), называется …
диффузионным; потенциалопределяющим. 12.5. Формула вещества, которое является ядром мицеллы, образующейся при взаимодействии раствора хлорида меди (II) с избытком сероводорода, имеет вид … 12.6. В коллоидной частице, образующейся при взаимодействии сульфата меди с избытком сероводорода, потенциалопределяющим является ион … 12.7. Коллоидная частица, образующаяся при взаимодействии избытка раствора йодида калия с раствором нитрата серебра, в постоянном электрическом поле … 12.8. Заряд гранулы золя, образующегося при взаимодействии разбавленного раствора хлорида меди (II) с избытком раствора гидроксида калия, определяется зарядом … 12.9. Коллоидная частица золя гидроксида железа (III), образующаяся при гидролизе его хлорида, в постоянном электрическом поле будет … Остается неподвижной; двигаться к аноду; совершать колебательные движения; двигаться к катоду. Дисперсные системы 13.1. Уравнения реакций, в результате которых происходит образование коло-идных растворов методом химической конденсации, имеют вид … Укажите не менее двух вариантов ответа CdCl2 + K2SO4 →; Cd(NO3)2 + NaOH →; BaCl2 + Na2SO4 →; Ba(NO3)2 + KOH →. 13.2. Уравнения реакций, в результате которых возможно образование коллоид-ных растворов, имеют вид … Укажите не менее двух вариантов ответа 13.3. Коллоидные растворы относятся к высокодисперсным системам, которые состоят из дисперсионной _____ и дисперсной … Укажите не менее двух вариантов ответа 13.4. Уравнения реакций, в результате которых возможно образование коллоидных растворов, имеют вид … Укажите не менее двух вариантов ответа 13.5. Активированный древесный уголь относится к дисперсным системам с _____ дисперсионной средой и ______ дисперсной фазой. Укажите не менее двух вариантов ответа 13.6. К методам получения коллоидных систем, основанным на образовании более крупных частиц из более мелких, относятся … Укажите не менее двух вариантов ответа Электрическое распыление; замена растворителя; химическая конденсация; пептизация. 13.7. Жемчуг относится к дисперсным системам с _____ дисперсионной средой и ______ дисперсной фазой. Укажите не менее двух вариантов ответа 13.8. Суспензии относятся к дисперсным системам, в которых дисперсная фаза находится в ____ агрегатном состоянии, а дисперсионная среда – в … 13.9. В отличие от истинных растворов коллоидные системы отличаются более низкой _______ и ________ устойчивостью. Укажите не менее двух вариантов ответа Потенциальной; дисперсионной; кинетической; агрегативной.
ДE N5. Физическая химия Коррозия металлов 19.1. При нарушении серебряного покрытия на никелевом изделии в кислой среде на катоде будет протекать реакция, уравнение которой имеет вид …
19.2. При нарушении никелевого покрытия на медном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид … 19.2. Для защиты медных изделий от коррозии в качестве катодного покрытия можно использовать … 19.3. При работе гальванического элемента, состоящего из кадмиевого и нике-левого электродов, погруженных в 0.02 М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид … 19.4. При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид … 19.5. При добавлении щелочи в раствор, содержащий ионы серебра Zn0|Zn2+ ||Ag+|Ag0, значение ЭДС гальванического элемента … 19.6. При добавлении щелочи в раствор, содержащий ионы железа (II), значение ЭДС гальванического элемента Fe0|Fe2+ || Ni2+|Ni0 … 19.7. Значение ЭДС гальванического элемента, состоящего из медного и марганцевого электродов при стандартных условиях, равно ___ В
0.84; 1.52; -0.84; -1.52 19.8. Значение ЭДС гальванического элемента, состоящего из ртутного и кадми-евого электродов, погруженных в 0.2 М растворы их нитратов, равно ___ В
-0.39; -1.19; 1.19; 0.39. 19.9. Значение ЭДС гальванического элемента, состоящего из цинкового и ни-келевого электродов, погруженных в 0.1 М растворы их нитратов, равно ___ В 19.10. Значение ЭДС гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в 0.2 М растворы их нитратов, можно увеличить, если …
Химическое равновесие 22.1. Уравнение реакции, в которой при изменении давления не происходит смещения равновесия, имеет вид … FeO(кр) + C(графит) ↔ Fe(кр) + CO(g); Fe2O3(кр) + 3CO(g) ↔ 2Fe(кр) + 3CO2(g); C(графит) + 2CO2(g) ↔ CO(g). 22.2. Согласно принципу Ле Шателье, понижение температуры вызывает смещение равновесия в системе в сторону … экзотермической реакции; эндотермической реакции. 22.3. Величина, значение которой количественно характеризует состояние химического равновесия при заданных условиях, называется …
внутренней энергией; константой равновесия. 22.4. Для увеличения выхода продуктов реакции в равновесной системе C(графит) + 2H2O(г) ↔ 2H2(г) + CO2(г); D rH 0 > 0;необходимо … повысить температуру; повысить давление. 22.5. Уравнение константы равновесия гетерогенной химической реакции MgCO3(т) ↔ MgO(т) + CO2(г) имеет вид … K = [CO2]; 22.6. Уравнение константы равновесия гетерогенной химической реакции PCl5(ж)
22.6. Если в колонне синтеза аммиака при 450 0С установилось равновесие N2(г) + 3H2(г) ↔ 2NH3(г), Δr H < 0, то для увеличения выхода продукта необходимо … увеличить давление; увеличить температуру. 22.7. Влияние изменений, которые происходят в равновесной химической системе под влиянием внешних воздействий, определяется … правилом фаз Гиббса; правилом Вант-Гоффа. Общие свойства растворов 24.1. Для понижения температуры замерзания раствора на 2.79 оС необходимо в 1000 г воды растворить ____ г ацетона (C3H6O). 130.5; 87; 174; 43.5. 24.2. Растворы, обладающие одинаковым осмотическим давлением, называются … 24.3. Уравнение P осм = CRT, характеризующее зависимость осмотического давления от концентрации раствора неэлектролита и температуры, называется законом … Менделеева - Клайперона; Дебая - Хюккеля; Вант - Гоффа; Бойля - Мариота. 24.4. Уравнение закона Рауля выражает зависимость между давлением насыщенного пара растворителя над раствором и _______ растворенного вещества. 24.5. Соотношение температур кипения растворов глюкозы (t 1) и сахарозы (t 2) с одинаковой массовой долей растворенного вещества, равной 1%, подчиняется выражению … 24.6. Уравнение закона Вант-Гоффа выражает зависимость между осмотическим давлением разбавленных растворов неэлектролитов при постоянной температуре и _______ растворенного вещества. 24.7. Метод определения молекулярной массы вещества-неэлектролита, осно-ванный на измерении понижения температуры замерзания его раствора, называется … 24.8. Соотношение значений осмотического давления растворов глюкозы (p 1осм) и сахарозы (p 2осм) при 25оС с одинаковой массовой долей растворенного вещества, равной 0,1%, подчиняется выражению … 24.9. Осмотическое давление мочевины при температуре 25оС составляет 619 кПа. Концентрация этанола в растворе, изотоничном данному раствору мочевины при той же температуре, равна ____ моль/л. 24.10. Для повышения температуры кипения раствора на 1.04оС необходимо в 500 г воды растворить ____ г мочевины (CO(NH2)2)
52; 30; 60; 104. 24.11. Для соотношения значений осмотического давления растворов метанола (p1) и этанола (p2) в воде при 20оС с одинаковой массовой долей растворенного вещества, равной 0.05 %, справедливо выражение … p1 < p2; p1 = p2; p1 > p2; p1 ≈ p2. Органическая химия Углеводороды 16.1. Образование бутадиена-1,3 происходит в результате реакции, схема которой имеет вид … BrCH2CH2CH2CH2Br + Mg → BrCH2CH2CH2CH2Br + 2KOH BrCH2CH2CH2CH2Br + 2KOH HOCH2CH2CH2CH2OH 16.2. Присоединение воды к пропину в присутствии соли ртути (II) протекает с образованием … 16.3. Основным органическим продуктом реакции пропионата натрия с гидро-ксидом натрия при нагревании является … 16.4. Образование пропанона происходит в результате реакции, схема которой имеет вид … CH3C ≡ CH + H2O CH ≡ CH + H2O 16.5. При окислении этена нейтральным раствором перманганата калия при комнатной температуре в качестве основного органического продукта образуется … 16.6. Качественным реагентом на этиленовые углеводороды является … Раствор HCl; аммиачный раствор оксида серебра; бромная вода; раствор KOH. 16.7. При взаимодействии 2-бромпропана с металлическим натрием в условиях реакции Вюрца в качестве основного органического продукта образуется … 16.8. Органическим продуктом окисления толуола раствором перманганата калия в присутствии серной кислоты при нагревании является … 16. 9. Основным органическим продуктом реакции ВМС Биополимеры 1.1. Продукт, образующийся при полном гидролизе макромолекул белков, представляет собой смесь … a-аминокислот; амидов карбоновых кислот. 1.2. Исходными веществами при синтезе макромолекул белков являются молекулы ___-аминокислот. g; a; b; d. 1.3. Природным сырьем, продукт обработки которого уксусным ангидридом используется в производстве ацетатного шелка, является … 1.4. Формула мономера, продуктом полимеризации которого является природный каучук, имеет вид … CH2 = CH - C6H5; CH2 = CH - CH = CH2. 1.5. Моносахаридом, который входит в состав макромолекул рибонуклеиновых кислот, является … 1.6. К природным веществам, имеющим полимерное строение, относится … 1.7. Вторичная структура белковой макромолекулы обусловлена наличием в ней ______ связей. 1.8. Получение пироксилина и целлулоида общей формулы [C6H10-xO5(NO2)x] n основано на обработке азотной кислотой такого природного полимера, как …
Методы получения полимеров 4.1. Формулы веществ, между которыми возможно протекание реакции поликонденсации, имеют вид … C6H5OH и CH2 = CHCOOH; C6H5OH и HCHO. 4.2. Соединение, полимеризацией которого получают вещество, являющееся основой клея ПВА, называется … 4.3. В реакцию поликонденсации может вступать вещество, формула которого … C6H5 - CH2 - COOH; NC - CH2 - CH2 - CN; CH3COO - CH = CH2; HOOCCH2 - CH2COOH. 4.4. В реакцию полимеризации может вступать вещество, формула которого имеет вид … C6H5 - COOCH3; C6H5 - NO2. 4.5. Схема получения полипропилена имеет вид … n(CH2 = CH - CH3) → (-CH2 - CH(CH3)-)n nCH2 = CHC6H5 → (-CH2 - CH(C6H5)-)n n(CH2 = CH2) → (-CH2 - CH2 -)n 4.6. Начальной стадией процесса полимеризации, сопровождающейся образованием активных центров, является … Ингибирование; рост цепи; стабилизирование; инициирование/ 4.7. К полимерам, обладающим термореактивными свойствами, относится … Полипропилен, эпоксидная смола, поливинилхлорид, полистирол. 4.8. Полимерный материал капрон является примером _____ волокна. Искусственного, неорганического, натурального, синтетического. 4.9. Исходным веществом для получения синтетического каучука по методу Лебедева является _____ спирт. 4.10. Мономером для получения изопренового (природного) каучука является … CH2 = CH - CH = CH2; CH2 = C(C6H5) - CH = CH2; C6H5 - CH = CH2. 4.11. Вещества, при взаимодействии которых с активными радикалами происхо-дит образование малоактивных центров, не способных инициировать дальнейший процесс полимеризации, называются … 4.12. Получение полистирола в промышленности основано на … полимеризации винилбензола; полимеризации винилацетата. 4.13. Формула вещества, являющегося исходным мономером для получения поливинилхлорида, имеет вид … CH2 = CHCH2Cl; ClCH = CHCl. Тесты по химии
ДE N2. Общая и неорганическая химия Способы выражения состава 5.1. Массовая доля гидрокарбоната натрия в растворе, полученном при смешении 50 г раствора с массовой долей NaНСO3 8% и 150 г раствора с массовой долей соли 4%, составляет ___ % (с точностью до целого значения). Введите ответ 5.2. Объем хлороводорода (н.у.), который содержится в 50 литрах 0.1 М раствора соляной кислоты, составляет ____ литра(ов) (с точностью до целого значения). Введите ответ 5.3. Массовая доля гидроксида натрия в растворе, полученном при разбавлении 200 мл 2.5М раствора NaOH в 5 раз, составляет ___ % (с точностью до целого значения; (rp-pa = 1 г/cм3). Введите ответ 5.4. Массовая доля сульфата меди (II) в растворе, полученном при растворении 50 г медного купороса (CuSO4∙5H2O) в 350 мл воды, составляет ____ % (с точностью до целого значения). Введите ответ 5.5. 50 г 49%-ного раствора серной кислоты разбавили водой до объема 500 мл. Молярная концентрация эквивалентов H2SO4 в полученном растворе составляет ____ моль/л (с точностью до целого значения). Введите ответ 5.6. Масса медного купороса, необходимого для приготовления 500 мл раствора сульфата меди (II) с массовой долей растворенного вещества 3,2% (r = 1 г/см3), составляет ____ г (с точностью до целого значения). Введите ответ 5. 7. Масса медного купороса, необходимая для приготовления 2 л 0.1 М раствора сульфата меди (II), составляет ____ г (с точностью до целого значения). Введите ответ 5.7. Масса серной кислоты, содержащейся в 1 мл раствора с молярной концентрацией эквивалентов H2SO4 равной 2 моль/л, составляет ____ мг (с точностью до целого значения). Введите ответ 5.8. Масса серной кислоты, содержащейся в 5 л раствора с молярной концентрацией эквивалентов H2SO4 равной 0.2 моль/л, составляет ____ г (с точностью до целого значения). Введите ответ 5.8. Масса кристаллогидрата (Na2CO3∙10H2O, необходимая для приготовле-ния 500 г раствора карбоната натрия с массовой долей растворенного вещества 10.6%, составляет ____ г (с точностью до целого значения). Введите ответ 5.9. Массовая доля хлорида кальция в растворе, полученном при смешении 300 г раствора с массовой долей CaCl2 15% и 200 г раствора с массовой долей 2,5%, составляет ___ % (с точностью до целого значения). Введите ответ. 5.10. Для приготовления 10 л 0.1 М раствора гидроксида натрия требуется ____ г твердой щелочи (с точностью до целого значения). Введите ответ.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 240; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.8.110 (0.121 с.) |
 = H2O + CO2 ↑, имеет вид …
= H2O + CO2 ↑, имеет вид … ; Na+; Cu2+.
; Na+; Cu2+. ; Ba2+; H+.
; Ba2+; H+. ; Ag+; Cl-.
; Ag+; Cl-.
 .
. .
. .
. ;
;  ;
; 
 PCl3(ж) + Cl2(г) имеет вид …
PCl3(ж) + Cl2(г) имеет вид … ; Kp = [Cl2];
; Kp = [Cl2];  ;
; 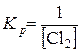
 .
. .
.


 ; CH3CH2CH2OH + CuO
; CH3CH2CH2OH + CuO  ;
;



