
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анилин п-толуидин о-анизидин о-фенилендиамин
Бензоламин 2-метиланилин 2-метоксианилин 1,2-бензолдиамин Фениламин о-толиламин о-метоксифениламин о-фенилендиамин
- бензиламин - N-метиланилин 1-фенилметанамин 1-фенилпропан-2-амин Метилфениламин бензиламин -
Ацетат 2,5-ксилидиния - Ацетат 2.5-диметиланилиния гидросульфат диметил-п-хлорфенилметиламмония ИЗОМЕРИЯ I. Структурная изомерия
В бензольном кольце п- изомер м-изомер
Изомерия углеродного скелета
II. Пространственная изомерия 1. изомерия (σ-связь С-С в sp3) 2. а) при наличии Асимметрического атома С (S) 1-фенил-1-этанамин
б) для четвертичных аммонийных солей С различными заместителями Отсутствует превращение пирамидальных конфигураций из одной в другую, как в аминах, где энергетический барьер всего 25 кДж/моль.
(R)-аллилбензилметилфениламмоний
ФИЗИЧЕСКИЕ СВОЙСТВА Ароматические амины – бесцветные жидкости или кристаллические вещества со специфическими запахами. Мало или нерастворимы в воде. Легко окисляются и темнеют. Токсичны (для анилина ПДК -0,1 мг/м3), некоторые концерогенны, как бензидин и β-нафтиламин.
Соли аминов – типичные ионные соединения. Нелетучие твердые вещества с высокой Тпл., многие растворимы в воде (галогениды, нитраты, сульфаты и др.) Различие в растворимости аминов и их солей используются для обнаружения аминов и выделения аминов из смеси соединений, не являющихся основаниями. СПОСОБЫ ПОЛУЧЕНИЯ I. Способы получения первичных аминов Восстановление нитросоединений Промышленный и лабораторный способ, доступны исходные вещества. При выборе восстановителя и условий проведения реакции учитывать восстановление других групп. Скорость восстановления групп: C=C < C=O < COOH < C≡N < CONH2 < NO2 а) каталитическое гидрирование водородом
Глубина восстановления зависит от условий ведения процесса.
б) химическое восстановление активным водородом Me + HX, где Me = Sn, Zn, Fe - железом в присутствии электролита (хлорида аммония) Не восстанавливаются альдегиды, производные кислот, азосоединения.
Производство анестезина, новокаина.
- оловом (или цинком) в соляной кислоте (лабораторный синтез)
- хлоридом олова Избирательное восстановление полинитросоединений, не восстанавливаются галогены в кольце.
- сульфидом и гидросульфидом аммония и щелочных металлов Неселективное моновосстановление полинитросоединений, не восстанавливает гидроксигруппу
Аммонолиз галогенопроизводных а) с алифатическими галогенопроизводными
Недостатки метода: смесь первичных, вторичных и третичных аминов, т.к. скорость каждой последующей стадии выше. Избыток аммиак и карбоната аммония увеличивает выход первичного амина. Разделение смеси – фракционная перегонка, химические методы. б) с ароматическими галогенопроизводными
3. Расщепление амидов по Гофману (синтез с уменьшением цепи).
4. Восстановление нитрилов и оксимов [H] = LiAlH4, H2/Ni Re, Na мет. в спирте
5. Восстановительное аминирование ароматических карбонильных соединений
II. Способы получения вторичных, третичных аминов Алкилирование первичных ароматических аминов (аминолиз) Получается смесь вторичных и третичных аминов, т.к. υ1 < υ2. а) алкилгалогенидами
б) спиртами
в) эфирами бензолсульфокислот
г) диметилсульфатом
Восстановительное аминирование алифатических карбонильных соединений
Побочный процесс – SEаром. по о- и п-положению. Синтез чистых вторичных аминов а) алкилирование имидов сульфокислот
б) синтез дифениламина
ЭЛЕКТРОННОЕ СТРОЕНИЕ
Неподеленная электронная пара атома азота вступает в сопряжение с ароматической π- системой (+М).
Данное электронное строение позволяет предположить следующую реакционную способность: 1. Кислотность N-H 4. SEаром. 2. Основность 5. окисление 3. Нуклеофильность ХИМИЧЕСКИЕ СВОЙСТВА I. Кислотность N-H-связи Ароматические амины слабые кислоты, рКа ~30-35, сильнее, чем NH3 и алканы.
II. Основность C минеральными и органическими кислотами донорно-акцепторным механизмом путем присоединения протона образуют четвертичные аммонийные соли.
Основность зависит от факторов: величина е-плотности на N, устойчивость катиона, сольватация исходного и конечного состояния. Влияние бензольного кольца
РКа 9.24 10.62 9.36 4.62 0.8 --
Введение арильного заместителя снижает основность атома азота, т.к. - уменьшается индуктивный эффект, -неподеленная пара электронов связана мезомерным эффектом, - нейтральная форма резонансно стабилизирована, а катион – нет.
Нейтр. Форма катион
|
||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1016; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.17.45 (0.012 с.) |



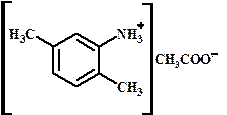
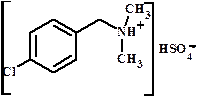

 1. положение заместителя
1. положение заместителя


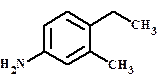
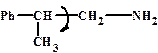 Конформационная
Конформационная Оптическая изомерия
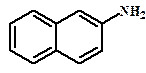
Оптическая изомерия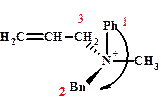






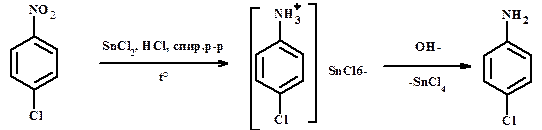



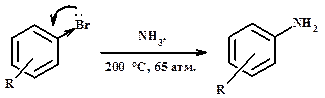 Низкая реакционная способность объясняется действием мезомерного эффекта, связь С-Hal укорачивается, реакция возможна при высокой температуре, с применением сильного основного реагента.
Низкая реакционная способность объясняется действием мезомерного эффекта, связь С-Hal укорачивается, реакция возможна при высокой температуре, с применением сильного основного реагента. При наличии электроноакцепторного заместителя, особенно в о- и п-положениях ускоряется процесс замещения.
При наличии электроноакцепторного заместителя, особенно в о- и п-положениях ускоряется процесс замещения.





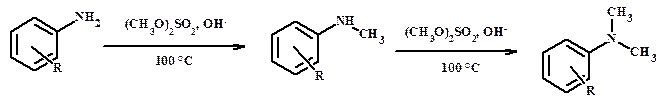



 По σ-связям C-N и N-H из-за разности электроотрицательности индуктивным эффектом электронная плотность смещена к атому азота (-I).
По σ-связям C-N и N-H из-за разности электроотрицательности индуктивным эффектом электронная плотность смещена к атому азота (-I). +M >> -I, следовательно, аминогруппа – сильный донор, вызывает перераспределение электронной плотности в кольце, о- и п-положениях δ-заряд.
+M >> -I, следовательно, аминогруппа – сильный донор, вызывает перераспределение электронной плотности в кольце, о- и п-положениях δ-заряд.



 Ароматические амины менее основные, чем алифатические.
Ароматические амины менее основные, чем алифатические.


