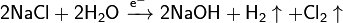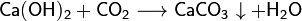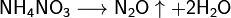Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оксиды. Получение. Общие химические свойства. Привести уравнение химической реакции. Назвать каждое соединение. ⇐ ПредыдущаяСтр 3 из 3
Оксиды – соединение, состоящее и двух элементов одним из которых является кислород в степени окисления -2. Получение: 1. Окисление простых и сложных веществ
2..Разложение гидроксидов
3.Разложение карбонатов и других солей
4.Взаимодействие металла с другим оксидом
Основные оксиды – образованы металлами (степень окисления металла +1;+2) пример: Na2O, MgO, MnO – металл. Искл: BeO, ZnO, SnO. Кислотные оксиды: неметаллы или металлы со степенью окисления +5, +6, +7 (V2O5, CrO3, Mn2O7 – металлы (оксид серы СО2) Амфотерные: степень окисления металла равна +3, +4 (Al2O3, Cr2O3, MnO2) исключения: BeO, ZnO, SnO. Хим.свойства: 1. С водой – оксиды щелочных металлов и щелочноземельных. Na2O+H2O=2NaOH BaO+H2O=Ba(OH)2 2. Кислотные оксиды с водой N2O5+H2O=2HNO3 SO3+H2O=H2SO4 3. Амфотерные с водой не реагируют. Примерами основных оксидов могут служить оксид кальция СаО и оксид магния MgO. Оксид кальция взаимодействует с водой, образуя гидро-ксид кальция Са(ОН)2: СаО + Н2О = Са(ОН)2. Примерами кислотных оксидов могут служить триоксид серы SO3 и диоксид кремния SiO2. Первый из них взаимодействует с водой, образуя серную кислоту H2SO4: SO3 + Н2О = H2SO4
Основания. Получение. Общие химические свойства. Привести уравнения химической реакции. Назвать каждое соединение. Основания – электролиты в результате диссоциации которых в водных растворах только один вид анионов – гидрооксиданионы OH. Получение: · Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя. · Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
· Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.
· Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
· Некоторые основания можно получить реакциями обмена:
· Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2. Хим.свойства: 1) С кислотами NaOH+HNO3=NaNO3+H2O Mg(OH)2+2HCl=MgCl+2H2O 2) С кислотными оксидами 2KOH+CO2=K2CO3+H20 3) C растворимыми солями CuSO4+2NaOH=Cu(OH)2 +Na2SO4 4) Разлагаются Mn(OH)2=MnO+H2O
Кислоты. Получение. Общие химические свойства. Привести уравнения химических реакций. Назвать каждое соединение. Кислоты - электролиты, в результате диссоциации которых в водных растворах образуется один вид катионов. Сильные (HCl, HBr, HI, HNO3, H2SO4) Слабые (H2S, H2S, O3, H2CO3, CH3COOH) Получение: Бескислородные кислоты получают: Взаимодействием неметалла с водородом. Например: H2 + Cl = 2HCl
Действием на соль более сильной или менее летучей кислотой. Например: FeS + 2HCl = FeCl2 + H2S↑ NaCl + H2SO4 = NaHSO4 + HCl↑
Кислородсодержащие кислоты получают: Взаимодействием кислотных оксидов с водой. Например: SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3
Действием на соль более сильной кислотой. Например: Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
Хим. свойства: С металлом (до водорода) Zn+2HCl=ZnCl+H2 С основным и амфотерным оксидам MgO+2HNO3=Mg(NO3)2+H2O С основаниями и амфотерными гидрооксидами 2NaOH+H2SO4=Na2SO4+2H2O C солями FeS+2HCl=FeCl2+H2S Кислоты. Получение. Общие химические свойства. Привести уравнения химических реакций. Назвать каждое соединение. Существуют различные методы получения солей: · Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:
· Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
· Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
· Взаимодействие простых веществ:
· Взаимодействие оснований с неметаллами, например с галогенами:
Химические свойства Химические свойства определяются свойствами катионов и анионов, входящих в их состав. · Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода или другие оксиды):
· Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
· Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменениемстепеней окисления атомов реагентов:
· Некоторые соли разлагаются при нагревании:
Примеры образования солей: Са(ОН)2 + H2SO4 = СаSO4 + 2Н2О, СаSO4 - нормальная соль - сульфат кальция;
КОН + H2SO4 = KHSO4 + Н2О, KHSO4 - кислая соль - гидросульфат калия;
Mg(OH)2 + HC1 = MgOHCl + Н2О, MgOHCl - основная соль - хлорид гидроксомагния
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.82.167 (0.019 с.) |