
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Присоединение других белков и пептидов
5. Вторичная структура пептидов и белков. α-Спираль, 310-спираль, параллельная и антипараллельная β-структуры, β-изгиб. Сверх-вторичная структура белков. Понятие о доменах.
β-кератина. Через 10 лет Л. Полинг и Р. Кори установили, что β-структура, или «складчатый лист»,— это стабилизированный межцепочечными водородными связями ассоциат вытянутых, зигзагообразных пептидных цепей. В зависимости от взаимной ориентации цепей различают параллельные и антипараллельные β- структуры. В фиброине шёлка полипептидные цепи расположены антипараллельно, а в β-кератине стягиваются дополнительно липопротеином серицином.
Одна из главных канонических форм полипептидной цепи была впервые обнаружена Л. Полингом и Р. Кори в 1951 г. и названа α-спиралью. В общем случае спиральная структура возникает, когда во всех звеньях полипептидной цепи углы поворота вокруг простых связей имеют одинаковые величину и знак, что и приводит к постепенному закручиванию цепочки. Структура α-спирали, помимо невалентных взаимодействий ближайших атомов, стабилизируется также внутримолекулярными водородными связями между С=О- и N—Н- группами полипептидного остова.
Радикалы аминокислотных остатков оказываются на периферии образованного спиралью цилиндра и могут, в зависимости от характера аминокислотных остатков, обеспечивать гидрофобную или гидрофильную природу этой цилиндрической поверхности.
Спираль 310, хотя и является напряженной, тем не менее существует в природе, в частности найдена в миоглобине и лизоциме. α- Спираль встречается в белках очень часто. Например, α- кератин является полностью α- спиральным белком, в миоглобине и гемоглобине содержание α- спирали составляет 75%, а в сывороточном альбумине — 50%. С другой стороны, имеются белки, в которых α- спиральные участки отсутствуют (например, нейротоксины змей) или их содержание невелико. Сверхвторичная структура. Следующий за вторичной структурой уровень организации полипептидной цепи связан с наличием ансамблей взаимодействующих между собой вторичных структур. В частности, имеются примеры агрегации α- спиралей с образованием суперспирализованных систем. Наиболее известна в этом отношении структура α- кератина шерсти. Три α- спиральные цепи кератина скручены в протофибриллы, которые, в свою очередь, объединены в микрофибриллу, образующую волос. Такая сверхвторичная структура объясняет, почему шерсть эластична, легко растягивается и после снятия усилия постепенно восстанавливает свою длину. В силу того, что межмолекулярные связи слабы, шерсть непрочна. В волокнах шерсти период идентичности (шаг спирали) равен 0,51 нм (а не 0,54нм, как в «канонической» а- спирали).
Весьма компактную левую тройную спираль образуют параллельные спирали типа полипролина в коллагене. Другая распространенная группа супервторичных структур — различные варианты так называемой βαβ- структуры, в которой а- спираль взаимодействует с β- складчатым листом. Чаще всего встречается структура βαβαβ. Многие белки содержат относительно слабо взаимодействующие между собой участки, которые называют доменами. Средний размер домена обычно составляет 100 — 150 остатков, что отвечает глобуле с поперечником около 2,5 нм. Вместе с тем встречаются и значительно большие домены. Вероятнее всего, формирование пространственной структуры белка вначале происходит внутри будущих доменов, а взаимная укладка доменов, т. е. образование третичной структуры, происходит на заключительных этапах формирования глобулы.
|
||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 479; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.123 (0.004 с.) |
 Регулярная структура полипептидной цепи предопределяет возможность формирования стандартных, так называемых канонических, конформаций, легко обнаруживаемых в нативной форме с помощью различных методов. Такого рода пространственно упорядоченные участки, стабилизированные водородными связями между пептидными СО- и NH- группами, называются элементами вторичной структуры. Исторически первой описанной пространственной конфигурацией полипептидной цепи была β-структура, предложенная У. Астбери в 1941 г. на основании рентгеноструктурных исследований
Регулярная структура полипептидной цепи предопределяет возможность формирования стандартных, так называемых канонических, конформаций, легко обнаруживаемых в нативной форме с помощью различных методов. Такого рода пространственно упорядоченные участки, стабилизированные водородными связями между пептидными СО- и NH- группами, называются элементами вторичной структуры. Исторически первой описанной пространственной конфигурацией полипептидной цепи была β-структура, предложенная У. Астбери в 1941 г. на основании рентгеноструктурных исследований

 Края антипараллельных β- структур образованы особым видом вторичной структуры, который называется β- изгибом (реверсивным поворотом). β-Изгибы образуются четырьмя последовательно расположенными аминокислотными остатками, как правило, образующими водородную связь 4 —> 1. Анализ показывает, что возможны два основных вида β-изгибов, так называемые изгибы типа I и II, отличающихся ориентацией пептидного карбонила по отношению к средней плоскости 10- членного цикла. β- Изгибы — характерный элемент пространственной структуры природных и синтетических олигопептидов, как линейных, так и циклических.
Края антипараллельных β- структур образованы особым видом вторичной структуры, который называется β- изгибом (реверсивным поворотом). β-Изгибы образуются четырьмя последовательно расположенными аминокислотными остатками, как правило, образующими водородную связь 4 —> 1. Анализ показывает, что возможны два основных вида β-изгибов, так называемые изгибы типа I и II, отличающихся ориентацией пептидного карбонила по отношению к средней плоскости 10- членного цикла. β- Изгибы — характерный элемент пространственной структуры природных и синтетических олигопептидов, как линейных, так и циклических.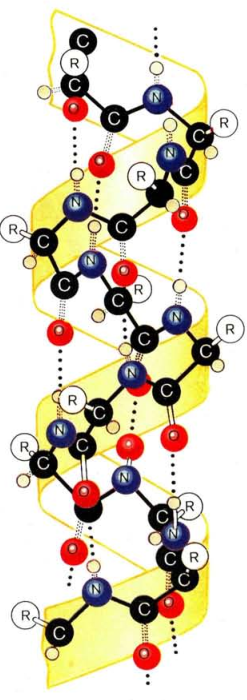 Один виток α-спирали образуют 3,6 аминокислотных остатка. Как и любая другая спираль, α- спираль может быть правой или левой. В белках встречаются только правые α- спирали. Наряду с α-спиралью возможно существование и других спиралей, имеющих иные параметры, — содержащих меньшее (например, так называемая З10- спираль) или большее (4,416 или π- спираль) число остатков на виток. В α- спирали каждая NH- группа полипептидного остова соединяется водородной связью с группой СО четвертого от нее аминокислотного остатка (5— > 1 связь), образуя 13- членный цикл. Так как в один виток α- спирали входит 3,6 остатка, то ее можно обозначить как 3,613- спираль. Аналогичным образом, с учетом размеров Н- связанных циклов, обозначаются и другие теоретически возможные типы спиралей.
Один виток α-спирали образуют 3,6 аминокислотных остатка. Как и любая другая спираль, α- спираль может быть правой или левой. В белках встречаются только правые α- спирали. Наряду с α-спиралью возможно существование и других спиралей, имеющих иные параметры, — содержащих меньшее (например, так называемая З10- спираль) или большее (4,416 или π- спираль) число остатков на виток. В α- спирали каждая NH- группа полипептидного остова соединяется водородной связью с группой СО четвертого от нее аминокислотного остатка (5— > 1 связь), образуя 13- членный цикл. Так как в один виток α- спирали входит 3,6 остатка, то ее можно обозначить как 3,613- спираль. Аналогичным образом, с учетом размеров Н- связанных циклов, обозначаются и другие теоретически возможные типы спиралей.


