
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ТЕРМОДИНАМИческие И ТЕРмохимические расчеты.
4.1. Составьте термохимические уравнения реакций и вычислите стандартную энтальпию образования D 01 – MnBr2, если при образовании 5 г его выделилось 14,3 кДж; 02 – MnCl2, если при образовании 5 г его выделилось 19,3 кДж; 03 – MnS, если при образовании 5 г его выделилось 11,76 кДж; 04 – Na2O, если при образовании 10 г его выделилось 67,6 кДж; 05 – K2O, если при образовании 10 г его выделилось 38,6 кДж; 06 – Rb2O, если при образовании 10 г его выделилось 17,6 кДж; 07 – Cs2O, если при образовании 10 г его выделилось 9,24 кДж; 08 – CrCl3, если при образовании 17 г его выделилось 60,5 кДж; 09 – CdI2, если при образовании 20 г его выделилось 10,9 кДж; 10 – CdBr2, если при образовании 18 г его выделилось 21,0 кДж; 11 – CdF2, если при образовании 4,6 г его выделилось 21,2 кДж; 12 – CdCl2, если при образовании 9,6 г его выделилось 8,2 кДж; 13 – CaS, если при образовании 6 г его выделилось 40,3 кДж; 14 – CaCO3, если при образовании 10 г его выделилось 120,9 кДж; 15 – CBr4, если при образовании10 г его выделилось 3,78 кДж; 16 – BiCl3, если при образовании 2,4 г его выделилось 2,06 кДж; 17 – BeO, если при сгорании 15 г бериллия выделилось 1020,6 кДж; 18 – BaF2, если при образовании 3 г его выделилось 20,6 кДж; 19 – BaCl2, если при образовании 1,75 его выделилось 7,3 кДж; 20 – As2O5, если при сгорании 7 г мышьяка выделилось 40,8 кДж; 21 – Al2S3, если при образовании 3,5 г его выделилось 11,9 кДж; 22 – AlCl3, если при образовании 5 г его выделилось 26,2 кДж; 23 – AgF, если при образовании 3 г его выделилось 4,83 кДж; 24 – Ag2O, если при сгорании 4,5 г серебра выделилось 2,57 кДж; 25 – H2Se, если при образовании 2 л его (н.у.) поглотилось 7,68 кДж; 26 – PCl3, если при образовании 27,5 г его выделилось 55,9 кДж; 27 – SO2, если при сгорании 1 г серы выделилось 29,9 кДж; 28 – CO2, если при образовании 1 л CO2 (н.у.) выделилось 15,8 кДж; 29 – AlF3, если при образовании 2,1 г его выделилось 32,4 кДж; 30 – Cr2O3, если при образовании 3,8 г оксида выделилось 30,8 кДж. 4.2. Вычислите количество тепла (кДж), выделяющееся при образовании из простых веществ в стандартных условиях:
4.3. Вычислите тепловой эффект процесса, D
01 – 2Al(тв) + 3NiO(тв) = Al2O3(тв) + 3Ni(тв) 02 – BaCO3(тв) + C(тв) = BaO(тв) + 2CO2(г) 03 – 2BaO(тв) + O2(г) = 2BaO2(тв) 04 – 3BaO(тв) + 2Al(тв) = 3Ba(тв) + Al2O3(тв) 05 – CaO(тв) + H2O(ж) = Ca(OH)2(тв) 06 – CaO(тв) + CO2(г) = CaCO3(тв) 07 – 2MgO(тв) + Si(тв) = 2Mg(тв) + SiO2(тв) 08 – Cr2O3(тв) + 2Al(тв) = 2Cr(тв) + Al2O3(тв) 09 – 3CuO(тв) + 2Al(тв) = 3Cu(тв) + Al2O3(тв) 10 – 3CuO(тв) + 2Fe(тв) = 3Cu(тв) + Fe2O3(тв) 11 – 2CuO(тв) + C(тв) = 2Cu(тв) + CO2(г) 12 – 2 AgF(тв) + H2(г) = 2Ag(тв) + 2HF(г) 13 – Ag2O(тв) + CO(г) = 2Ag(тв) + CO2(г) 14 – Ag2O(тв) + H2(г) = 2Ag(тв) + H2O(ж) 15 – Na2O2(тв) + 2Na(тв) = 2Na2O(тв) 16 – 2NaOH(тв) + 2Na(тв) = 2Na2O(тв) + H2(г) 17 – 4 NaOH(тв) + 3Fe(тв) = 4Na(тв) + Fe3O4(тв) + 2H2(г) 18 – 2Na2CO3(тв) + 3Fe(тв) = 4Na(тв) + Fe3O4(тв) + 2CO(г) 19 – 2NaHCO3(тв) = Na2CO3(тв) + H2O(ж) + CO2(г) 20 – Na2CO3(тв) + 2C(тв) = 2Na(г) + 3CO(г) 21 – 2NaOH(тв) + C(тв) = 2Na(тв) + CO(г) + H2O(ж) 22 – 3Fe(тв) + 2O2(г) = Fe3O4(тв) 23 – 2FeO(тв) + Si(тв) = 2Fe(тв) + SiO2(тв) 24 – Fe2O3(тв) + 3CO(г) = 2Fe(тв) + 3CO2(г) 25 – FeO(тв) + CO(г) = Fe(тв) + CO2(г) 26 – Fe3O4(тв) + CO(г) = 3FeO(тв) + CO2(г) 27 – 3Fe2O3(тв) + CO(г) = 2Fe3O4(тв) + CO2(г) 28 – 3Fe3O4(тв) + 8Al(тв) = 9Fe(тв) + 4Al2O3(тв) 29 – Fe2O3(тв) + 2Al(тв) = 2Fe(тв) + Al2O3(тв) 30 – Fe2O3(тв) + 3H2(г) = 2Fe(тв) + 3H2O(ж). 4.4. Вычислите изменение стандартной энтропии, D 01 – CO2(г) + CaO(тв) = CaCO3(тв) 02 – CO2(г) + BaO(тв) = BaCO3(тв) 03 – B2O3(тв) + 3Mg(тв) = 2B(тв) + 3MgО(тв) 04 – KClO4(тв) = KCl(тв) + 2O2(г) 05 – SO2(г) + 0,5O2(г) = SO3(г) 06 – PbS(тв) + 4O3(г) = PbSO4(тв) + 4O2(г) 07 – CuS(тв) + 1,5O2(г) = CuO(тв) + SO2(г) 08 – 2CO(г) + O2(г) = 2CO2(г) 09 – 2Al(тв) + 3S(тв) = Al2S3(тв) 10 – Al(тв) + 1,5Cl2(г) = AlCl3(тв) 11 – Al(тв) + 1,5Br2(ж) = AlBr3(ж) 12 – Al(тв) + 1,5I2(тв) = AlI3(тв) 13 – 2Ag(тв) + Cl2(г) = 2AgCl(тв) 14 – BeO(тв) + Mg(тв) = MgO(тв) + Be(тв) 15 – CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г) 16 – C(ГРАФИТ) + 2S(тв) = CS2(ж) 17 – Be(тв) + Cl2(г) = BeCl2(тв) 18 – CdS(тв) + 1,5O2(г) = CdO(тв) + SO2(г) 19 – 3FeO(тв) + 0,5O2(г) = Fe3O4(тв) 20 – 2FeO(тв) + 0,5O2(г) = Fe2O3(тв)
21 – H2(г) + S(тв) = H2S(г) 22 – H2S(г) + 1,5O2(г) = H2O(ж) + SO2(г) 23 – I2(тв) + Br2(ж) = 2IBr(г) 24 – I2(тв) + 3Cl2(г) = 2ICl3(тв) 25 – H2O2(ж) = H2O(ж) + 0,5O2(г) 26 – Fe2O3(тв) + 3H2(г) = 2Fe(тв) + 3H2O(ж) 27 – Fe3O4(тв) + 4CO(г) = 3Fe(тв) + 4CO2(г) 28 – 3Fe(тв) + 4H2O(ж) = Fe3O4(тв)+ 4H2(г) 29 – CuO(тв) + H2(г) = Cu(тв) + H2O(ж) 30 – Fe2O3(тв) + CO(г) = 2FeO(тв) + CO2(г). 4.5. Вычислите изменение стандартной энергии Гиббса, D 01 – AgF(тв) + 0,5Cl2(г) = AgCl(тв) + 0,5F2(г) 02 – Be(тв) + H2O(ж) = BeO(тв) + H2(г) 03 – B2O3(тв) + 3CO(г) = 2B(тв) + 3CO2(г) 04 – BaO2(тв) + CO(г) = BaCO3(тв) 05 – BaO2(тв) = BaO(тв) + 0,5O2(г) 06 – BaCO3(тв) = BaO(тв) + CO2(г) 07 – BaO(тв) + H2(г) = Ba(тв) + H2O(ж) 08 – BaO(тв) + C(ГРАФИТ) = Ba(тв) + CO(г) 09 – BaO(тв) + CO(г) = Ba(тв) + CO2(г) 10 – B2O3(тв) + 3H2(г) = 2B(тв) + 3H2O(ж) 11 – 2C(ГРАФИТ) + 4Al(тв) = Al4C3(тв) 12 – 2B(тв) + 3H2(г) = B2H6(г) 13 – 2HI(г) + 0,5O2(г) = H2O(ж) + I2(тв) 14 – 2HBr(г) + 0,5O2(г) = H2O(ж) + Br2(ж) 15 – 2H2(г) + Si(тв) = SiН4(г) 16 – P(тв) + 1,5H2(г) = PH3(г) 17 – CaCO3(тв) = CaO(тв) + CO2(г) 18 – 2HCl(г) + O3(г) = Cl2(г) + H2O(ж) + O2(г) 19 – 2HF(г) + 0,5O2(г) = H2O(ж) + F2(г) 20 – H2O(ж) + O3(г) = H2O2(ж) + O2(г) 21 – 0,5Cl2(г) + O2(г) = ClO2(г) 22 – CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г) 23 – CO2(г) + 2H2S(г) = CS2(г) + 2H2O(ж) 24 – COS(г) + H2O(ж) = CO2(г) + H2S(г) 25 – CO2(г) + 2HCl(г) = COCl2(г) + H2O(ж) 26 – BaO(тв) + SO3(г) = BaSO4(тв) 27 – CH4(г) + 3CO2(г) = 4CO(г) + 2H2O(ж) 28 – Mg(тв) + CO2(г) = MgO(тв) + CO(г) 29 – MgCO3(тв) = MgO(тв) + CO2(г) 30 – CO(г) + S(г) = COS(г). 4.6. Вычислите изменение энергии Гиббса, DG0 (кДж), следующих реакций, протекающих при указанной температуре (зависимостью D
ХИМИЧЕСКая кинетика 5.1. Напишите математическое выражение закона действующих масс для реакций:
5.2. Зависимость скорости химической реакции от концентрации реагирующих веществ а) Как изменится (во сколько раз) скорость реакции, если концентрацию первого реагирующего вещества увеличить в три раза:
Ответ обоснуйте, проведя соответствующие вычисления. б) Как изменится (во сколько раз) скорость реакции, если концентрацию второго реагирующего вещества увеличить в три раза:
Ответ обоснуйте, проведя соответствующие вычисления. в) Как изменится (во сколько раз) скорость реакции, если концентрации реагирующих веществ увеличить в два раза:
Ответ обоснуйте, проведя соответствующие вычисления. г) Как изменится (во сколько раз) скорость реакции при увеличении давления в два раза:
Ответ обоснуйте, проведя соответствующие вычисления д) Как изменится (во сколько раз) скорость реакции при уменьшении давления в 4 раза:
Ответ обоснуйте, проведя соответствующие вычисления.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 327; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.243.184 (0.049 с.) |
 , (кДж/моль) следующих веществ:
, (кДж/моль) следующих веществ: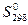 (Дж/К), при протекании следующих процессов:
(Дж/К), при протекании следующих процессов: (кДж), и определите возможность осуществления в стандартных условиях следующих реакций:
(кДж), и определите возможность осуществления в стандартных условиях следующих реакций:


