
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация металлов (по А.П.Гуляеву)Стр 1 из 15Следующая ⇒
Классификация металлов (по А.П.Гуляеву) Все металлы условно поделены на черные и цветные. Черные металл обычно имеют темно – серый цвет, большую плотность (кроме щелочных), высокую температуру плавления, относительно высокую твердость. Некоторые из них (железо, титан, кобальт, марганец, цирконий, уран и др.), обладают полиморфизмом (аллотропией). Наиболее типичным черным металлом является железо. Цветные металлы имеют красную, желтую, белую окраску. Они обладаю большой пластичностью, малой твердостью, низкой температурой плавления. Известно, что олово имеет полиморфизм. Типичный представитель - медь. К черным металлам относятся: - железные металлы – железо, кобальт, никель, марганец; - тугоплавкие металлы; имеют температуру плавления выше чем у железа, т.е. более 15390С – титан, ванадий, хром, цирконий, ниобий, молибден, вольфрам, технеций, гафний, рений; - урановые металлы (актиноиды) – торий, актиний, уран, нептуний, плутоний и др. (с 89 до 103 элемента); - редкоземельные металлы (с 57 -71 элементы), лантан, церий, ниодим и д.р.; - щелочноземельные металлы – литий, натрий, кальций, калий, рубидий, стронций, цезий, барий, франций, родий, скандий. К цветным металлам относятся: - легкие – бериллий, магний, алюминий; - благородные металлы – рутений, радий, палладий, осмий, иридий, платина, золото, серебро и полублогородная медь; - легкоплавкие металлы – цинк, кадмий, ртуть, галлий, индий, талий, германий, олово, свинец, мышьяк, сурьма, висмут. К металлам и сплавам относятся вещества получаемые порошковой металлургией. Классификация неметаллических материалов: - органические и неорганические полимеры; - пластмассы; - композиционные материалы; - каучуки и резины; - клеящие материалы и герметики; - лакокрасочные покрытия; - графит; - стекло; - керамика.
Методы изучения строения металлов Для изучения структуры сплавов и металлов, определения причин их разрушения используются следующие основные методы анализа: - химический анализ на элементы; - спектральный анализ определения элементов; - ренгено – спектральный анализ элементов; - определение механических свойств с помощью различного оборудования. К основным механическим свойствам относятся: предел прочности, текучести, пропорциональности (σВ, σТ, σПР); относительное удлинение и сужение (
- металлографический структурный анализ производят на оптических электронных микроскопах; - ренгено - структурный анализ на оборудовании с использованием рентгеновских лучей. В последние 1980 – 1990 годы разработаны сканирующие туннельные микроскопы, атомные силовые микроскопы, которые позволяют изучать металлы и сплавы на атомно – молекулярном уровне с манипулированием единичными молекулами.
Кристаллизация металлов, фазовые превращения Пути повышения прочности металла 1.7.1. Создание металлов и сплавов с бездефектной структурой; повышением плотности дефектов, затрудняющих движения дислокации. В настоящее время получены ните- видные кристаллы (усы), прочность которых в 50-15 раз больше прочности обычного металла. 1.7.2. Создание искусственного наклепа объёмного и особенно поверхностного (нагартовки). 1.7.3. Легирование металла в т.ч. железа элементами таблицы Менделеева. 1.7.4. Получение наследственно-мелкозернистого зерна путем регулируемой кристаллизации, модифицирования, модификаторами первого (V, Ti, Mo, Nb, Ta и др.) и второго рода (Ca, Mg, РЗМ и др.). 1.7.5. Очистка металла от вредных примесей S, P, Sb, As, газов H, N, O. При этом повышаются все механические свойства, уменьшается способность распространения трещин. 1.7.6. Термическая обработка, термомеханическая обработка. 1.7.7. Уменьшение шероховатости поверхности деталей. 2 Теория сплавов
Понятие о сплавах Сплав – это вещество, полученное сплавлением, спеканием, электролизом, возгонкой двух или более элементов. Сплав, приготовленный из металлов или имеющий металлическую основу и обладающий металлическими свойствами называется металлическим сплавом (МС). МС более сложное вещество, чем чистый металл, МС обладают более высокими прочностными и другими механическими свойствами по сравнению с чистыми металлами. Им часто придаются специфические свойства. Поэтому они получили более широкое применение.
Характер взаимодействия компонентов в сплавах зависит от их положения в таблице Менделеева, особенностей строения атомов, их электронных оболочек, типов и параметров решёток, соотношения температур плавления, их атомных диаметров, растворимости друг в друге и других факторов. МС может быть: а) механической смесью, б) химическим соединением, в) раствором элементов друг в друге с неограниченной или ограниченной растворимостью, а также их промежуточными смесями. Механическая смесь двух и более компонентов возможна тогда, когда металлы (вещества, элементы) не растворимы в твёрдом состоянии и не вступают в химическую реакцию с образованием соединений. Рентгенограмма показывает наличие двух решёток компонентов А и Б, что соответствует чистым металлам. Механические свойства соответствуют и зависят от количества компонентов А и Б. Химическое соединение (ХС). При образовании ХС достигается следующее: - соотношение атомов элементов соответствует стехиометрической пропорции Аm × Вn; - образуется новая отличная от элементов кристаллическая решётка с упорядоченным расположением атомов; - ХС характеризуется определёнными физическими свойствами (температура плавления, удельный вес, электро- и теплопроводность, мехсвойства, запах, вкус, ковкость, пластичность и т.д.). Если ХС образуется металлами, то в углах решётки располагаются атомы (ионы), между ними электронный газ. К таким элементам относятся Cu2MnSn, CuAl2, CuAu, CuAg и т.п. Связи жёсткие, химические соединения образуются без учёта валентности. При образовании химсоединения металла с неметаллом возникает ионная связь. Элементы удерживаются электронным притяжением (NaCl, KMnO4 и т.д.) В жидком состоянии большинство металлических сплавов представляют однородные жидкие растворы. При переходе в твёрдое состояние однородность сохраняется, сохраняется и растворимость. Рентгеновский анализ обнаруживает только один тип решётки. В отличие от механических смесей твёрдый раствор является однофазным. В отличие от химического соединения твёрдый раствор существует не при строго определённом соотношении компонентов, а в интервале концентрации. Различают твёрдые растворы замещения и внедрения. Замещают металлы друг друга, заменяя в узлах решётки. Внедряются в металл обычно элементы с малым диаметром атома (C, H, N и др.). С образованием твёрдых растворов внедрения периоды решётки увеличиваются. Замечено, что неограниченная растворимость наблюдается у элементов относительно близко расположенных друг от друга в периодической системе. Если элементы расположены друг от друга далеко и имеют различную физическую природу, то они чаще всего склонны к образованию химических соединений, а не твёрдых растворов. Химические соединения могут также образовывать растворы замещения, растворять другие атомы. Например, борид железа (Fe4B2) способен растворять хром, углерод. Электронные соединения могут образовывать металлы следующих групп: Cu, Ag, Au, Fe, Co, Ni, Pt, Pd, Be, Zn, Cd, Al, Sn, Si Электронные соединения встречаются в важнейших сплавах: Cu-Zn; Cu-Sn; Fe-Al; Cu-Si; Al-Si; Cu-Al и т.д. Обычно в системе наблюдаются три фазы (β, γ, ε). Электронные соединения промежуточные между хим. соединениями и твёрдым раствором.
Диаграммы состояния представляют собой графическое изображение фаз и структур в зависимости от температуры, давления и концентрации элементов. Фаза – это однородная часть системы, отделённая от других частей системы (фаз) поверхностью раздела, при переходе через которую изменяется состав, часто решётка, структура скачкообразно. Компоненты – вещества, образующие систему. Состояние одного компонента – прямая линия; диаграмма состояния 2-х компонентов системы – плоская фигура (на оси ординат откладывается t 0С, на оси абсцисс – концентрация элементов); 3-х компонентная система – пространственная фигура с основанием в виде треугольника и т.д. Линия начала кристаллизации называется точкой ликвидуса, конец кристаллизации – точка солидуса. Имеются следующие диаграммы: а) диаграмма состояния 1-го рода описывает 2-х компонентную систему, где компоненты нерастворимы друг в друге (рис. 22). Сплав с минимальной температурой плавления (точка С) называется эвтектикой, температура – эвтектической. Количество компонентов находят по правилу отрезков: линия 1 - s определяет всё количество сплава, t - s - количество оставшейся жидкости В доэвтектических сплавах содержится компонент А совместно с эвтектикой (АВ), в заэвтектических содержится компонент В с эвтектикой (АВ). б) диаграмма состояния 2-го рода описывает сплавы с неограниченной растворимостью в жидком и твёрдом состоянии (рис 23). Выше АСВ находится область жидкой фазы (ж); между АСВ и АDВ расположена двухфазная область (
а б а – диаграмма состояния; б – схемы получающихся структур
Рисунок 22 – Диаграмма состояния I рода и схемы получающихся структур
а б
а – кривые охлаждения; б – диаграмма состояния
Рисунок 23 – Диаграмма состояния для случая неограниченной растворимости компонентов А и В в твёрдом и жидком состоянии в) диаграмма состояния 3-го рода описывает сплавы с ограниченной растворимостью в твёрдом состоянии, не образующих химическое соединение. На рисунке 24 изображена диаграмма с эвтектикой, на рисунке 25 – с перитектикой. Перитектическая реакция ж+
а б а – кривые охлаждения; б – диаграмма состояния
Рисунок 24– Кривые охлаждения и диаграмма состояния сплавов, образующих ограниченные твердые растворы и эвтектику
Рисунок 25 – Диаграмма состояния сплавов, образующих ограниченные твердые растворы и испытывающих перитектическое превращение Ограниченная растворимость наиболее часто встречается в металлических сплавах. Линия а-с-в ликвидус, линия a-d-c-e-в – солидус. Выше “acв” расположена жидкость, между “асв” и “adceв” – жидкость и кристаллы Правее лини “в-e-к” находится Разберем пример сплава 1. Сплав 1 между точками t1 - t2 состоит из жидкости и Сплавы, расположенные левее точки d однофазные и лучше обрабатываются давлением, хуже льются.
При кристаллизации часто наблюдается разность химсостава по сечению литой заготовки. Этот процесс называется ликвацией. Разберём коротко диаграмму с перетектикой (рис.25). Точка d характеризует максимальную растворимость компонента B в A, а точка “e”- предельную растворимость A в B. Линия “CDE” – линия перетектического превращения. При эвтектическом превращении кристаллизуется сразу 2 фазы, при перетектическом превращении кристаллизуется одна фаза из ранее выпавшей твёрдой фазы и жидкости. Из жидкого раствора правее точки d из жидкой фазы в начале выделяется Неизрасходованная часть жидкости и кристаллы Кристаллизация сплавов по “c-d” происходит по формуле жс+ г) диаграмма состояния сплава, образующего устойчивое химическое соединение (рис. 26) Аm × Вn. Устойчивых соединений может быть 1,2,3…
Рисунок 26 – Диаграмма состояния IV рода
д) диаграмма состояния с неустойчивым химическим соединением представлена на рисунке 27. На линии d-c-t в равновесии находится три фазы: Жд+кристаллы компонента В и кристаллы химсоединения An Bm. Выше линии DCF происходит An Bm
Рисунок 27 – Диаграмма состояния с неустойчивым химическим соединением е) диаграмма состояния для сплавов, испытывающих полиморфные (аллотропические) превращения показана на рисунке 28. В приведённых выше диаграммах рассматривалась первичная и вторичная кристаллизации, закалка. Вторичная кристаллизация происходит, если хотя бы один компонент претерпевает аллотропические (полиморфные) превращения (Fe, Mn, Co, Ti, Sn, и некоторые другие). В диаграммах а-б-в-г на рисунке 28 в верхней части происходит первичная кристаллизация, в нижней вторичная. В диаграмме “a” закалка возможна в зоне С-Д-Р, т.к. находится 2 фазы. В диаграмме “б” две фазы находится в области CDF, в диаграмме “в” упрочнение происходит в области, где одновременно присутствует 2 фазы (
Рисунок 28 – Диаграммы состояния с полиморфными превращениями Перечисленные выше диаграммы равновесные, т.е. выполнены при малых скоростях охлаждения. Изучив теоретическую кристаллизацию, можно рассматривать неравновесные условия, когда могут не происходить диффузионные процессы при различных переохлаждениях. В реальных условиях первые кристаллы имеют большую концентрацию тугоплавкого компонента. Последующие кристаллы самые легкоплавкие. Это явление называется ликвацией. Она может быть уменьшена длительным диффузным отжигом или обработкой давлением. Неравновесная кристаллизация происходит при большом переохлаждении. Чем больше переохлаждение, тем мельче будут вторичные кристаллы, тем напряжённей и неустойчивее система. Получается пересыщенный раствор одного компонента в другом – мартенсит, который прочен, твёрд. Этот процесс называется закалкой. Нагревая сплав после закалки, мы приводим систему в более устойчивое состояние, снижая прочность. Этот процесс называется отпуском или старением. С помощью термообработки можно изменять механические свойства сплавов.
Диаграмма железо – углерод Железоуглеродистые сплавы (стали, чугуны) важнейшие, так как их производят 90-95% от общего производства всех металлов. Начало изучению диаграммы положено Д.К.Черновым, П.П.Амосовым. Было указано о существовании критических точек в стали, дано первое представление о диаграмме Fe-С. Зарубежные учёные Осмонд, Ле – Шателье, Аустенит, русские – Байков, Гудцов, Гуляев развивали науку о диаграмме Fe-С. Железо плавится при 1539 0С. В твёрдом состоянии оно имеет три решётки a (ОЦК), g (ГЦК) и a1 (ОЦК). Fea существует до 911 0С, Feg - от 911 до 1392 0С, Fea1 - 1392-1539 0С. Техническое железо имеет относительно низкую прочность sв – 20 При 768 0С и выше железо становится немагнитным. Железо со многими элементами образует сплавы (растворы): а) с металлами – растворы замещения, с Fe3C также раствор замещения; б) с лёгкими элементами – растворы внедрения (C, B, N, и др.). Растворимость углерода в железе зависит от его кристаллической решётки. В Fea растворится от 0,005% (20 0С) до 0,02% (723 0С), в Feg растворится максимально 2,14% углерода. В ОЦК решётке (Fea) имеется 12 свободных мест в середине рёбер. Свободное место (пора) имеет размер 0,62 А0. Диаметр атома углерода 1,54 А0. Такой размер недостаточен для помещения в него атома углерода. В Feg (ГЦК) решётке в центре имеется пора диаметром 1,02 А0. В этой поре помещается атом углерода, увеличивая размер g - железа. Твёрдый раствор внедрения углерода и других элементов в a - железо называется ферритом (рис. 29), а в g железо – аустенитом (рис. 30).
Рисунок 29 – Микроструктура технического железа. Феррит
Рисунок 30 –Структура аустенита углеродистой стали, выявленная травлением при высоких температурах
Цементит (Ц, Fe3C) – это химическое соединение углерода с железом (карбид железа), имеющий свою решётку, физико-химические свойства (рис 31). Температура плавления ~ 1500 0С, не полиморфен, слабо магнитен. Он имеет высокую твёрдость (80 HRС), низкую пластичность. Цементит с железом и другими металлами образует твёрдые растворы замещения. Углерод может замещаться азотом, кислородом, бором и др., атомы железа металлами: Mn, Cr, W, Ni, Co, Cu и т.д. Такой твёрдый раствор на базе решётки цементита и железа называется легированным.
Рисунок 31 – Кристаллическая структура цементита
Диаграмма Fe – C изображена на рисунке 32.
Рисунок 32 – Диаграмма фазового состояния Fe-Fe3C
Линия ABCД – ликвидус, AHJECF – солидус. В системе существуют следующие фазы: - жидкий сплав (раствор) углерода в железе обозначается Ж или Z; - цементит (Fe3C) линия ДFKL (Ц); - феррит (Fea, Ф, a) расположен в областях GPQ и AHN; - аустенит (Feg, А, g) занимает область NJESG. На диаграмме имеется три горизонтальные линии HJB, ECF, PSK указывающие на протекание трёх реакций. При 1499 0С ЖB+ФН ®АJ; реакция протекает у сплавов, содержащих углерод от 0,1 до 0,5 %. Реакция – перитектическая. При 1147 0С протекает эвтектическая реакция ЖС ®AE +ЦF в результате образуется механическая смесь аустенита и цементита – эвтектика – ледебурит. Реакция протекает у всех сплавов, содержащих углерод более 2,14%. При температуре меньше 727 0С ледебурит состоит из перлита и цементита. При 727 0С протекает эвтектоидная реакция AS ®ФР +ЦК. Продуктом её является механическая смесь феррита и цементита вторичного – перлит (рис. 33). Перлитное превращение происходит у всех сплавов, содержащих углерод более 0,02%.
Рисунок 33 – Структура перлита
Диаграмма Fe – Fe3C – метастабильная. Концентрация углерода для характерных точек следующая: B – 0,51 %C, H – 0,1 %C, J – 0,16 %C, E – 2,14 %C, C – 4,3 %C, S – 0,8 %C, P – 0,02 %C. В системе Fe – Fe3C имеются сплавы: сталь и чугун. Стали содержат углерод до 2,14 %, чугуны от 2,14 до 6,67 %, сталь, содержащая 0,8 % углерода называется эвтектоидной, чисто перлитной. Стали доэвтектоидные (конструкционные) содержат до 0,8 % углерода; стали, содержащие углерод от более 0,8 до 2,14 называются заэвтектоидными (инструментальными). На рисунке 34 показана доэвтектоидная (Ф+П), эвтектоидная (П) и заэвтектоидная (П+Ц2) стали. Перлит имеет кристаллы феррита вперемешку с кристаллами цементита.
а б в
а – доэвтектоидная сталь; б – эвтектоидная сталь; в – заэвтектоидная сталь
Рисунок 34 – Микроструктура сталей
Чугун, содержащий углерода больше 2,14%, но меньше 4,3% называется доэвтектическим (конструкционным), 4,3% - эвтектическим, а при содержании углерода более 4,3 но менее 6,67 – заэвтектическим. На рисунке 35 изображены названные чугуны. Доэвтектический чугун (рис. 35 а) содержит структуру П+Л (П+Ц2)+Ц2, эвтектический чугун (рис. 35 б) содержит ледебурит (П+Ц). Заэвтектический чугун (рис. 35 в) содержит Л (П+Ц)+Ц1.
а б в
а – доэвтектический чугун; б – эвтектический чугун; в – заэвтектический чугун
Рисунок 35 –Микроструктура чугунов
Углеродистые стали Основным продуктом чёрной металлургии является сталь, которую выплавляют из чугуна и возвратного металлолома. ~ 90 % выплавляется углеродистых сталей, 10 % легированных. Стали сочетают высокую прочность и твёрдость, ударную вязкость и пластичность, жёсткость с достаточной циклической прочностью. Эти параметры можно менять в широких пределах за счёт изменения содержания углерода, легирующих и модификаторов, термической и химикотермической обработки. Основа (матрица) углеродистых сталей - железо. Любая сталь содержит углерод, марганец, кремний и случайные элементы: хром, никель, медь и другие. В стали, содержатся также вредные примеси S, P, иногда Sb, As и другие, а также газы: кислород, азот, водород. Стали выплавляют в конвертерах, мартеновских, электродуговых, индукционных печах. По способу выплавки, раскислению стали, делятся на спокойные (СП), полуспокойные (ПС), кипящие (КП). По содержанию углерода они подразделяются на низкоуглеродистые (≤ 0,25% С), среднеуглеродистые (0,25 – 0,7 % С) и высокоуглеродистые (С>0,7 %). По назначению стали классифицируются на конструкционные и инструментальные. К конструкционным сталям относятся улучшаемые (закалка + отпуск), высокопрочные, цементуемые, рессорно-пружинные, строительные, арматурные, для холодной штамповки, шарикоподшипниковые, износостойкие, криогенные, жаропрочные и многие другие. Инструментальные стали подразделяются для режущего, измерительного инструментов, изготовление штампов. По структуре в равновесном состоянии стали делятся на доэвтектойдные Ф + П (рис.36 а, б, в, г), эвтектойдные П (рис.36 д), и заэвтектойдные П + Ц2 (рис.36 е). Первые – конструкционные, вторые и третьи – инструментальные. По качеству, стали делятся на обыкновенного качества (общего назначения), качественные и высококачественные. Под качеством понимается совокупность свойств: химсостав, мелкозернистость, строение и механические свойства, легированность и модифицирование, содержание вредных примесей (сера, фосфор), газов (водород, азот, кислород). Стали обычного качества содержат S≤0,050 и P ≤ 0,045 %, качественные (≤ 0,030) каждого элемента, высококачественные - (≤ 0,020). Стали, применяемые в оборонной промышленности содержат S и Р≤0,010, Н ≤ 4мл/100гр, N≤0,01 %, О ≤0,01 %.
а б в
г д е
Рисунок 36 – Структура стали с разным содержанием углерода
Чугуны Чугун – более дешёвый материал, чем сталь. Чугун – сплав железа с углеродом, которого содержится от 2,14% до 6,67%. Он имеет более низкую температуру плавления, высокую жидкотекучесть, хорошую обрабатываемость резанием, повышенную коррозионную стойкость, серые чугуны могут быть антифрикционными из-за свободного графита. Чугуны могут быть серыми и белыми в зависимости от формы присутствия углерода в сплаве. Fe3 Cà 3 Fe + C Исходя из формулы ясно, что если чугун охлаждать быстро, то получим белый чугун, так как цементит не будет распадаться. Если охлаждать медленно, то реакция будет протекать слева направо с выделением свободного графита и получится серый чугун. Серые чугуны в свою очередь подразделяются на собственно серые, ковкие, высокопрочные. Собственно серые чугуны обозначаются буквами «Сч» с добавлением цифр, обозначающих предел прочности «на разрыв». Например, Сч-10, Сч15,…Сч35. Графит имеет форму пластинок, чешуек разной величины (дисперсности) (рис.37 а). Чем меньше частички графита, тем меньше концентраторов напряжений и выше механические свойства. Пластинчатая форма графита имеет в целом больше концентратов напряжений по сравнению с хлопьевидным и шаровидным графитом, поэтому мехсвойства ниже, чем у ковкого, высокопрочного чугунов. Показатели мехсвойств должны соответствовать ГОСТ 1412-84. (таблица 5). В зависимости от химсостава, скорости охлаждения, термообработки чугуны бывают ферритного, феррито-перлитного, перлитного, перлито-цементитного классов (рис. 38) При легировании чугуна Mn, Ni, Co, N, Cu, Pt можно получать чугуны аустенитного класса. Из собственно серого чугуна Сч 10, Сч 15 ферритного класса изготавливают слабо и средне нагруженные детали: крышки, фланцы, диски сцепления и т.д. Из чугунов Сч 20-25 ферритно-перлитного класса изготавливают картеры двигателя, поршни, станины слабонагруженных станков. Из чугунов Сч 30…Сч35 перлитного класса изготавливают корпуса насосов, компрессоров. Получить серые чугуны с высокими мехсвойствами возможно модифицированием их 90%-ым ферросилицием, силикокальцием.
а б в
а – пластинчатые включения; б – шаровидные; в – хлопьевидные
Рисунок 37 – Внешний вид графитовых включений в чугуне
Таблица 5 – Временное сопротивление разрыву при растяжении чугуна в литом состоянии (ГОСТ 1412-85)
а б в
а – перлитный чугун; б – феррито-перлитный чугун; в – ферритный чугун
Рисунок 38 – Микроструктура серого чугуна
Ковкие серые чугуны обозначаются Кч-30, Кч35…, Кч-80. Часто добавляют к прочности на разрыв относительное удлинение, тогда марка обозначается Кч-30-6, Кч-60-3, Кч-80-1,5 и т.д. (таблица 6).
Таблица 6 –Механические свойства ковких чугунов (ГОСТ 1215-79)
В ковких чугунах графит имеет хлопьевидную форму (рис. 37 в). Концентраторов напряжений меньше, чем у серого чугуна и механические свойства выше. Получить ковкий чугун можно двумя способами: а) отжиг белого чугуна при температурах ~ 9500С. Происходит реакция Fe3 C à 3Fe + C и в определённое время графит принимает хлопьевидную форму отжига. Охлаждают чугун обычно через 15 часов; б) модифицирование жидкого чугуна CaSi, РЗМ, магниевыми лигатурами: Bi, Te, Al, B, Ti и др. Ковкие чугуны бывают ферритного, ферритно-перлитного, перлитного классов в зависимости от химсостава, термообработки, модифицирования. Из ковкого чугуна изготавливают чугунную запорную арматуру, ответственные изделия в сельскохозяйственном, автомобильном машиностроении, в судо, - котло, - вагоно,- дизелестроении. Высокопрочные чугуны обозначаются Вч-35… Вч100 ГОСТ 7293-85. Они имеют относительное удлинение от 2 до 22% твердость от 140 до 360 HB. Графит в высокопрочном чугуне имеет форму идеальных шаров (рис. 37 б), поэтому концентраторов напряжений ещё меньше и ещё выше механические свойства. Получают высокопрочный чугун только модифицированием жидкого расплава и только магнием. Высокопрочные чугуны могут быть ферритного, феррито-перлитного, перлитного классов. Рекомендуемое содержание углерода в высокопрочных чугунах от 2,8 до 3,8%. Из высокопрочных чугунов изготавливают прокатные валки, корпуса паровых турбин, каленвалы, литые заготовки тяжело нагруженных тормозных систем, детали, работающие при циклических нагрузках. Иногда высокопрочные чугуны закаливают и отпускают (500-6000С) для повышения механических свойств. Относительное удлинение, твердость и ударная вязкость определяются по требованию заказчика. Структура и свойства серого чугуна зависят как от свойств металлической основы (матрицы), так и от количества, формы графита, характера цементита. Относительное удлинение у собственно серого чугуна (Сч) равно 0,2-0,5%, у ковкого 5-15%, у высокопрочного 5-15%. Нижние значения, типичны для перлитных чугунов, верхние – для ферритных чугунов. Твёрдость перлитного чугуна ~ 250 НВ, феррито-перлитного ~ 200 НВ, ферритного ~ 150 НВ. Белые чугуны можно подразделить на углеродистые и легированные. Углерод в белых чугунах содержится в виде химического соединения цементита, карбида железа (Fe3C). Белые чугуны тверды, хрупки, износостойки. Углеродистые белые чугуны, с помощью отжига можно превращать в ковкие чугуны и собственно серые. Высоколегированные белые чугуны, содержащие много карбидов Mn, Cr, Ti, W, V, Mo и других остаются белыми после любой термообработки (рис. 39). Белые чугуны обозначаются, например, ИЧХ 15Г4НТ, ЧХ 28Н2Т, ЧХН4Г7 и т.д. (Износостойкий чугун хромистый, чугун хромистый, далее идёт обозначение легирующего элемента и его содержания в процентах).
а б в
г д е
Микроструктура поверхности: а – песчано – глинистая форма; б – песчано – глинистая форма с холодильником; в – металлическая форма Микроструктура сердцевины: г – песчано – глинистая форма; д – песчано – глинистая форма с холодильником; е – металлическая форма
Рисунок 39 – Микроструктура доэвтектического хромомарганцевого чугуна ИЧ210Х12Г5, кристаллизовавшегося при разной скорости охлаждения (плоская плита толщиной 100 мм)
В чугунах всегда содержится Mn, Si, вредные примеси S и Р, газы Н,N,О и сопутствующие элементы Cr, Ni, Cu. Вредные примеси S и Р, газы Н,О,N снижают все механические свойства.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1266; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.225.173 (0.202 с.) |
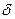 ,
,  ); твердость (H), ударная вязкость (КС). Определение свойств на износ, живучесть, ползучесть, коррозию, усталость и другие производят при необходимости на спецоборудовании:
); твердость (H), ударная вязкость (КС). Определение свойств на износ, живучесть, ползучесть, коррозию, усталость и другие производят при необходимости на спецоборудовании: ; линия 1 - t - количество кристаллов
; линия 1 - t - количество кристаллов  .
. +ж), ниже АDВ -
+ж), ниже АDВ - 

 .
.

 - фазы. В точке С образуется эвтектика – сплав
- фазы. В точке С образуется эвтектика – сплав  2- фаз.
2- фаз. 



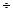 25
25  ; sт – 10-12
; sт – 10-12 
















