
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення електрохімічного еквівалента
РЕЧОВИНИ ТА ОБЧИСЛЕННЯ ВЕЛИЧИНИ ЕЛЕМЕНТАРНОГО ЗАРЯДУ Мета роботи: Ознайомитись з явищами електролітичної дисоціації, електролізу; використовуючи явище електролізу; визначити електрохімічний еквівалент міді; обчислити величину елементарного заряду. Прилади і матеріали: 1) мідний вольтаметр, 2) лабораторний випрямляч В-24, 3) реостат (33 Ом, 3 А), 4) амперметр, 5) вимикач, 6) з'єднувальні провідники, 7) шматок наждачного паперу, 8) технічні важільні терези з набором важків, 9) секундомір.
Короткі теоретичні відомості Речовини, молекули яких у розчині розпадаються на іони, називаються електролітами. Такий процес розпаду молекул називається електролітичною дисоціацією. До електролітів відносять водні розчини солей, кислот, лугів, а також розплавлені солі. Електричний струм в електролітах обумовлений рухом позитивних і негативних іонів під дією зовнішнього електричного поля. Тому провідність.електролітів, на відміну від електронної провідності в металах, називають іонною, а електроліти провідниками другого роду. Проходження постійного струму через електроліти супроводжується виділенням складових частин цих речовин на електродах. Це явище називається електролізом. Якщо ввести в електроліт два електроди, з'єднані з полюсами джерела постійної напруги, то під дією електричних сил іони в розчині почнуть рухатись до електродів: до аноду будуть рухатись від'ємні іони (аніони), до катоду – додатні іони (катіони). Досягнувши електродів, іони розряджаються: аніони віддають аноду електрони, катіони сприймають електрони від катоду. Наприклад, молекули мідного купоросу Крім цього розчин має також водневі Н+ і гідроксильні ОН‑ іони води. Йони міді Іони Якщо анод виготовлений з міді, то розряд іонів відбувається тільки біля катоду, а біля аноду, навпаки, іони металу переходять в розчин внаслідок реакції міді з сірчаною кислотою. В цьому випадку замість виділення кисню буде відбуватись перехід з аноду в розчин іонів
І закон Фарадея: Маса речовини, яка виділилась на електроді, пропорційна величині заряду
де І – величина струму, що проходить через електроліт, t – час проходження струму, k – електрохімічний еквівалент речовини. Електрохімічний еквівалент показує, яка кількість речовини виділяється на електроді при проходженні через електроліт одиниці кількості електрики. 2 закон Фарадея: Електрохімічні еквіваленти речовин пропорційні їх хімічним еквівалентам
де С – коефіцієнт пропорційності, А – атомна вага (для міді А=63,54х10-3 кг/моль), z – валентність речовини (для міді z=2). Величина А/z називається хімічним еквівалентом речовини. Отже,
При виділенні одного кілограм-еквівалента речовини (
Величина F = 1/C називається числом Фарадея. Це число показує, який заряд переноситься одним кілограм-еквівалентом речовини. Тому
В одному кіломолі будь-якої речовини міститься однакове число атомів:
Якщо заряд одного іона рівний Zе, де е – заряд електрона, Z – валентність, то заряд, який переносять
а маса речовини, яка виділиться на електроді, буде рівна
Отже, Порівнюючи вирази (5) і (9) бачимо, що
Звідки Заряд одновалентного іона чисельно дорівнює заряду електрона. Тому заряд електрона можна знайти за формулою:
Хід роботи 1. Скласти схему згідно з рис.1. Встановити силу струму
3. Визначити масу катодної пластинки 4. Встановити електрод на місце в електролітичну ванну. Одночасно з вмиканням кола, пустити секундомір. Пропускати струм постійної величини протягом 20-30 хв.
5. Вимкнути одночасно коло і секундомір. Висушити і зважити катод. Знайти масу міді, що виділилась як різницю мас катода після проходження струму ( 6. Результати для обчислення електрохімічного еквівалента міді занести в таблицю:
Таблиця для обчислення числа Фарадея і елементарного заряду:
7. Обчислити абсолютну і відносну похибку шуканих величин.
Контрольні запитання 1. Які речовини називають електролітами? Наведіть приклади. 2. Що обумовлює існування електричного струму в електролітах? 3. Який тип провідності є характерним для електролітів? 4. Надайте класифікацію провідників за типами провідності. 5. Яке фізичне явище називають електролізом? 6. Що називають катодом, анодом, катіоном, аніоном? 7. Сформулюйте і поясніть закони Фарадея для електролізу. 8. Дайте означення електрохімічного еквівалента речовини, в яких одиницях він вимірюється в СІ? хімічного еквівалента речовини, в яких одиницях він вимірюється в СІ? 9. Що таке валентність речовини? 10. Що називають числом Фарадея, в яких одиницях воно вимірюється в СІ? 11. Що називають числом Авогадро, в яких одиницях воно вимірюється в СІ? 12. Чому дорівнює табличне значення величини елементарного заряду виміряного в СІ? 13. Який зв'язок між числом Фарадея, хімічним еквівалентом і електрохімічним еквівалентом речовини? 14. У чому полягає суть розглядуваного методу з вимірювання електрохімічного еквіваленту речовини та величини елементарного заряду?
Лабораторна робота № 4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 2208; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.143.239 (0.009 с.) |
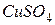 дисоціюють на позитивні іони
дисоціюють на позитивні іони 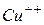 і негативні іони
і негативні іони  :
:  .
.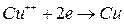 .
.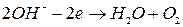 . Іони
. Іони 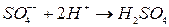 .
.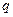 , що пройшов через електроліт, тобто
, що пройшов через електроліт, тобто , (1)
, (1)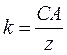 , (2)
, (2)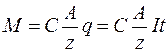 (3)
(3)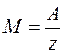 ) кількість електрики, яка проходить через електроліт дорівнює
) кількість електрики, яка проходить через електроліт дорівнює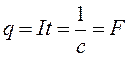 . (4)
. (4)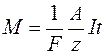 . (5)
. (5)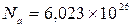 кмоль–1 (число Авогадро). Тоді маса одного йона (масами відірваних від атома електронів нехтуємо) дорівнює
кмоль–1 (число Авогадро). Тоді маса одного йона (масами відірваних від атома електронів нехтуємо) дорівнює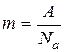 .. (6)
.. (6) іонів буде:
іонів буде: , (7)
, (7)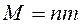 . (8)
. (8)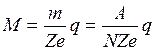 . (9)
. (9) . (10)
. (10)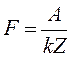 (11)
(11)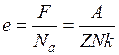 (12)
(12)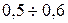 А.
А.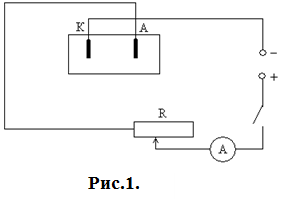 2. Вийняти катодну пластинку, ретельно обчистити її з обох боків.
2. Вийняти катодну пластинку, ретельно обчистити її з обох боків.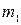 .
.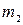 ) і до проходження струму (
) і до проходження струму (


