
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Результати аналізу записують у формі таблиці ⇐ ПредыдущаяСтр 4 из 4
Контрольні запитання 1 У чому суть аналітичного методу визначення у підземних водах сульфатів за допомогою титриметра? 2 Чому використання титриметра підвищує точність визначення сульфат-іону у водах? 3 Який основний принцип роботи титриметра? 4 Що таке коефіцієнт сульфатності?
Література 1 Дубей Н.В. Гідрогеологія та інженерна геологія. Підручник для ВНЗ. Івано-Франківськ. – електронний варіант.2009.-262с. 2 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. - М.: Недра, 1972. – 280с. 3 Климентов П.П., Богданов Г.Я. Общая гидрогеология. - М.: Недра, 1977. – 357с. 4 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ.- Івано-Франківськ: Факел, 2009.- 184с.
Лабораторна робота № 7
УЗАГАЛЬНЕННЯ РЕЗУЛЬТАТІВ ХІМІЧНИХ АНАЛІЗІВ ДОСЛІДЖУВАНИХ ПІДЗЕМНИХ ВОД ТА ВИЗНАЧЕННЯ ВМІСТУ НАТРІЮ
Мета і завдання роботи В даній роботі перед студентами ставиться мета - навчитись узагальнювати результати хімічних аналізів підземних вод та аналітичним способом визначати вміст іону натрію у воді. Завдання даної лабораторної роботи – з метою підведення підсумку виконаних досліджень хімічного складу підземної води необхідно: 1) перерахувати результати аналізів води з іонної форми у міліграм-еквівалентну та процент-еквівалентну; 2) розрахунковим способом визначити вміст натрію у воді; 3) описати хімічний склад води за допомогою формули Курлова; 4) визначити назву води за її хімічним складом; 5) оцінити ступінь мінералізації води; 6) оцінити воду за значенням рН; 7) визначити тип води за її твердістю; 8) оцінити придатність води для водопостачання населення. Основні теоретичні положення
Хімічний склад природних вод прийнято виражати у ваговій іонній, еквівалентній і процент-еквівалентній формах. Вагова іонна форма – вираження складу води у вагових кількостях окремих іонів. Вміст іонів у міліграмах або у грамах відноситься до об’ємної або вагової одиниці води. Еквівалентна форма – вираз складу води у міліграм – еквівалентах окремих іонів. Ця форма дозволяє більш точно враховувати хімічні властивості води, контролювати результати аналізу і вираховувати вміст натрію, виходячи з рівності суми аніонів і суми катіонів, якщо їх вміст дано в еквівалентній формі.
Процент-еквівалентна форма є модифікацією еквівалентної форми. Вона показує відносну долю кожного іону у загальній сумі розчинених іонів. Загальна сума всіх іонів, взятих в еквівалентній формі, прирівнюється до 100%, а сума катіонів, що дорівнює сумі аніонів, складає 50%. Для наочного зображення хімічного складу вод застосовують формулу Курлова. Ця формула представляє собою псевдодріб, у чисельнику якого вказують вміст у процент-еквівалентній формі головних аніонів, а в знаменнику – відповідно вміст катіонів, причому величини вмісту записують у вигляді індексів. Іони розташовують в порядку зменшення. Перед дробом відмічають концентрацію компонентів газового складу, символи специфічних компонентів і величину загальної мінералізації води М в г/дм³; праворуч від дробу – значення показників рН та Еh, окисність в міліграмах О на літр (мгОл), температуру води в ºС. Наприклад: Fe В назву води за її хімічним складом включаються аніони і катіони, вміст яких перевищує 25%-екв. Причому М.Г.Курлов пропонував називати воду, ставлячи аніони, а потім катіони у порядку зменшення. В наведеному прикладі назва води буде: залізиста, вуглекисла гідрокарбонатна кальцій-натрієва. Порядок проведення роботи
Результати хімічних аналізів досліджуваної підземної води записують у таблицю 8.1. Таблиця 8.1
Після перерахунку результатів аналізу з іонної форми (мг/л) в міліграм-еквівалентну (мг-екв) та процент-еквівалентну форму (%-екв) складають таблицю 8.2
Таблиця 8,2 (приклад)
Вагову іонну форму переводять у еквівалентну шляхом ділення на еквівалентну масу, або множення на коефіцієнт перерахунку.
Вміст кожного іону, що виражений у процентах від суми всіх іонів, дає процент-еквіваленту форму вираження іонно-сольового складу води. Склавши пропорції, де сума всіх іонів у еквівалентній формі дорівнює 100%, знаходять процентний вміст послідовно всіх іонів
і - х%
де і – вміст іону у еквівалентній формі; х – вміст іону у процент-еквівалентній формі. Якщо аніони і катіони дані у еквівалентній формі, то перед символом іона ставлять знак r (реагуюча величина), наприклад: rCa
Використовуючи цю рівність, можна визначити вміст натрію, одного з шести основних іонів.
Іншими іонами, крім головних, можна знехтувати, оскільки їх вміст незначний. Для визначення вмісту натрію в іонній формі отриману величину rNa За даними таблиць 8.1 і 8.2 необхідно скласти формулу Курлова і визначити назву досліджуваної підземної води за її хімічним складом (як приклад, до таблиці 8.2 формула Курлова і назва води наведені вище). За ступенем мінералізації, значенням рН та за величиною твердості досліджувану воду оцінюють, використовуючи додатки 1,2. Провівши узагальнення результатів хімічних аналізів досліджуваної підземної води, необхідно зробити висновки щодо придатності води для пиття за вмістом іонів, мінералізацією, загальною твердістю згідно ГОСТ 2874-82 (додаток 3). Оформлення звіту 1 Індивідуальні результати хімічних аналізів і розрахунків занести в таблиці (див. таблиці 8.1 і 8.2). 2 Скласти формулу Курлова і визначити назву досліджуваної води за її хімічним складом. 3 Зробити висновки щодо придатності води для пиття.
Контрольні запитання 1 Які ви знаєте форми вираження хімічного складу підземних вод? 2 Як визначається вміст натрію в підземних водах розрахунковим шляхом? 3 Що таке формула Курлова? 4 Як визначити назву води за формулою Курлова? Література 1 Дубей Н.В. Гідрогеологія та інженерна геологія. Підручник для ВНЗ. Івано-Франківськ. – електронний варіант.2009.-262с. 2 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. - М.: Недра, 1972. – 280с. 3 Климентов П.П., Богданов Г.Я. Общая гидрогеология. - М.: Недра, 1977. – 357с. 4 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ.- Івано-Франківськ: Факел, 2009.- 184с.
Д одаток 1
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 307; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.63.136 (0.013 с.) |
 (CO
(CO  )
) 

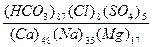 pH7,5;Eh+100; T+11
pH7,5;Eh+100; T+11
 Cl
Cl


 (8.1)
(8.1) (8.2)
(8.2) - сума аніонів і катіонів у еквівалентній формі;
- сума аніонів і катіонів у еквівалентній формі; . Сума катіонів, виражена в еквівалентній формі, дорівнює відповідно вираженій сумі аніонів, тобто:
. Сума катіонів, виражена в еквівалентній формі, дорівнює відповідно вираженій сумі аніонів, тобто: (8.3)
(8.3) (8.4)
(8.4)


