
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення ізобарної теплоємності повітря при атмосферному тиску
Мета і задачі проведення лабораторної роботи Засвоєння і закріплення теоретичного розділу з теплоємності, дослідне визначання середньої ізобарної теплоємності речовини, набуття навиків обробки дослідних даних. У результаті виконання лабораторної роботи студент повинен: знати: - визначення поняття теплоємності; - класифікацію теплоємностей; методи визначення теп-лоємності речовини; - призначення елементів лабораторної установки; - методику обробки дослідних даних; вміти: - виконувати необхідні вимірювання, визначати середню теплоємність; - виконувати перерахунок з однієї теплоємності на іншу; - користуватися таблицями теплоємностей; - виконувати розрахунок похибок і оцінювати точність дослідних даних; робити висновки з виконаної роботи.
Теоретичні основи
Багато процесів зміни стану робочого тіла супроводжується теплообміном з навколишнім середовищем. У цьому випадку теплота або підводиться до робочого тіла, або відводиться від нього. Для дослідження таких процесів необхідно вміти визначити кількість підведеної або відведеної теплоти. Теплоємність являє собою відношення кількості теплоти dQ одержаної речовиною при нескінченно малій зміні її стану в будь-якому процесі, до зміни температури речовини dT. Сх=(dQ/dT)х. (4.1) Теплоємність речовини є величиною екстенсивною, тобто залежить від кількості речовини. Теплоємність, віднесена до одиниці маси називається масовою (С), до одиниці об’єму, взятої за нормальних умовах - об’ємною (С ¢), до одного кмоля речовини - мольною (Сm), тобто С=С / m=dQ / (m ·dT), (4.2) C¢=C/v=dQ/(VdT), (4.3) Cm=C/N=dQ/(NdT), (4.4) де m - маса речовини, кг; V - об’єм речовини, м³; N - кількість речовини, кмоль. Теплоємність речовини не є величиною постійною, а залежить від температури і характеру процесу. Розрізняють істинну теплоємність,тобто теплоємність при даній (конкретній) температурі, і середню теплоємність – в інтервалі температур. Істинна теплоємність визначаються за формулою (4.1), а середня за формулою Сm=Q/DTx. (4.5) Зв’язок між істинною і середньою теплоємностями встановлюється співвідношенням: Схm= Значення теплоємності речовини залежить від характеру процесу підводу теплоти. В розрахунках найчастіше всього використовують ізобарну Cp і ізохорну Сv теплоємності.
Cp=(dQ/dT)p (4.7) Cv=(dQ/dT)v (4.8) Залежність між масовою ізобарною і масовою ізохорною теплоємностями ідеального газу встановлюється рівнянням Майєра: Сp=Cv+R, (4.9) де R - питома газова стала, Дж/(кг×К) Залежність між теплоємностями Сp i Сv реальних газів встановлюється за допомогою диференціальних рівнянь термодинаміки і може бути записана у вигляді: Сp-Cv=T(dP/dT)v(dV/dT)p (4.10) Для твердих і рідких тіл різниця між теплоємностями Сp і Cv мала, так як об’єм цих тіл мало змінюється при нагріванні. Теплоємність можна визначити різними методами. Наприклад, за формулою Ейнштейна, одержаної на основі квантової теорії Планка: Сmn=i1Rm/2+SRm(q/T)²(eq/T/(eq/T-1)²), (4.11) де i1 - число степеней вільності поступального і обертального руху молекул; Rm - універсальна газова стала, кДж/(кмоль×К); i2 - число степеней вільності внутрішньомолекулярних коливань; q - характерна температура коливального руху, К; е - основа натуральних логарифмів; Т - абсолютна температура газу, К; Ця формула не є абсолютно точною, так як при її виведенні були зроблені деякі допущення. Для наближення розрахунків при не дуже високих температурах можна використати теплоємності Сp і Cv, які одержані на основі молекулярно-кінетичної теорії теплоємності. Точні значення теплоємностей ідеальних газів використовуються на основі спектроскопічних даних з використанням математичного апарату квантової статистики. Значення цих теплоємностей приводяться в спеціальних таблицях. Теплоємності реальних газів і речовин частіше всього визначаються дослідним шляхом. Основними дослідними методами є: метод нагріву окремої порції речовини і метод протоку. Дослідним шляхом найпростіше визначати масову і об’ємну ізобарну теплоємності. Значення теплоємностей на основі дослідних даних можна визначити за формулами: Сpm=Q/(mDT)=Q/(m(T2-T1)), (4.12) C¢pm=Q/(V0DT)=Q/(V0(T2-T1), (4.13) де Q - теплота,яка підводиться до речовини при Р=сonst, кДж; m - маса речовини, кг; DT - зміна температури речовини, К; T1 - початкова температура речовини, °С; T2 - кінцева температура речовини, °С; V0 – об’єм речовини, приведений до нормальних умов, м³.
У відповідності з розрахунковими формулами (4.12) і (4.13) лабораторна установка для визначення теплоємності повинна мати пристрій для підведення теплоти до дослідної речовини, а також вимірювальні пристрої для визначення значень Q, m, V0, T1, T2 або DТ. У більшості випадків підведення теплоти до дослідної речовини здійснюються за допомогою електронагрівача. Для визначення теплоти Qe, яка виділяється електронагрівачем, необхідно знати силу струму І, спад напруги U і час нагрівання t. Маса m речовини може бути визначена ваговим і об’ємним способами. Значення температур на початку t1 i в кінці t2 підведення теплоти здійснюється за допомогою термопар або термометрів опору і відповідних вторинних приладів (потенціометрів, логометрів). Об’єм газу V0 визначається за допомогою газового лічильника або витратоміра.
Опис лабораторної установки
Принципова схема лабораторної установки представлена на рис.4.1. Повітря за допомогою нагнітача 1 прокачується через калориметр 9, де нагрівається за рахунок теплоти, яка виділяється електричним нагрівачем 8, який живиться змінним струмом. За допомогою вимикача 13, регулювання теплового потоку від нагрівника повітря здійснюється трансформатором 12. Падіння U напруги на нагрівника визначається за допомогою вольтметра 10, сила струму І в ланцюгу нагрівника – амперметром 11. Нагнітач підключається до мережі з допомогою вмикача 4. Об’єм повітря, який пройшов через калориметр за час t, вимірюється за допомогою лічильника 2 при різниці показників в кінці V1 i на початку заміру V2. Температура повітря на вході в калориметр і на виході з нього вимірюється за допомогою термометрів опору 7 і визначається за показами логометра 5. Підключення термометрів опору до логометра здійснюється за допомогою перемикача 6. Надлишковий тиск повітря pм за нагнітачем 1 вимірюється тягонапороміром 3.
1 – нагнітач; 2 – лічильник газу; 3 – тягонапоромір; 4 – вмикач; 5 – логометр; 6 – перемикач; 7 – термометр опору; 8 – нагрівник; 9 – калориметр; 10 – вольтметр; 11 – амперметр; 12 – трансформатор; 13 – вмикач; 14 – лампочка.
Рисунок 4.1 – Принципова схема лабораторної установки Порядок виконання роботи
Ознайомтесь з лабораторним стендом і призначенням приладів. Занесіть в табл.4.1 характеристики вимірювальних приладів, а в табл.4.2 - значення барометричного тиску pб і температури навколишнього середовища tн.с.. Встановіть ручку трансформатора обертанням проти годинникової стрілки в стан “0”. З дозволу викладача увімкніть установку в мережу включателем 13. Повинна загорітися лампочка 14. В протилежному випадку повідомте викладача. Встановіть за допомогою ручки трансформатора 12 падіння напруги на нагрівачі U (за вказівкою викладача). Включіть нагрівач 1 вмикачем 4. Досягніть встановленого режиму, при якому різниця темпе-ратур не буде змінюватися на протязі 5 хвилин (DT = t2 – t1 = = const). Таблиця 4.1 - Характеристика вимірювальних приладів
* - При витраті повітря від 4 до 8 м3/год приведена похибка дорівнює ±3%.
Таблиця 4.2 – Дослідні дані
Проведіть 5 замірів. Час заміру 1-2 хвилини. Час між замірами - 5 хвилин. Результати замірів занесіть в табл.4.2. Після закінчення експерименту відключіть установку від мережі. Ручку трансформатора встановіть в положення “0”. Зробіть обробку дослідних даних за методикою, викладеною нижче. Результати обробки дослідних даних занесіть в табл.4.3. Результати оцінки похибки досліду занесіть в табл.4.4.
Обробка дослідних даних Теплота, яка виділяється електронагрівачем за час заміру t, Дж. Q=IUt, (4.14) де I - сила струму в електронагрівачі, А; U - спад напруги на електронагрівачі, В; t - час заміру, с. Об’єм повітря, який пройшов через калориметр за час заміру: V=V2-V1, (4.15) де V2 - покази лічильника в кінці заміру, м3; V1 - покази лічильника на початку заміру, м3. Абсолютний тиск повітря на вході в калориметр: p=pб+pм, (4.16) де pб - барометричний тиск повітря, Па; pм - надлишковий тиск повітря в калориметрі, Па. Об’єм повітря, приведений до нормальних умов: V0=2,69×10-3pV/T1, (4.17) де T1 - термодинамічна температура повітря на вході в калориметр, К. Середня ізобарна об’ємна теплоємність повітря, кДж/(м³×К): С ¢pm=Q/(V0DT), (4.18) Середня масова ізобарна теплоємність повітря, кДж/(кг×К): Сpm=22.4C¢pm/m, (4.19) де 22,4 - об¢єм одного кіломоля повітря за нормальних умов, м³/кмоль; m - молярна маса повітря, рівна 28,96 кг/ кмоль. Середня мольна ізобарна теплоємність повітря, кДж/ (кмоль×К): Сmpm=22.4C'pm. (4.20) Максимально можлива відносна похибка визначення теплоємності: dС¢pm=(|dI + dU + dV0 + dDT|), (4.21) де dI, dU, dV0 і dDT - максимально можливі відносні похибки вимірювання відповідно сили струму, падіння напруги, об’єму повітря і різниці температур. Максимально можлива відносна похибка вимірювання величини W(I,U,V,T) за допомогою приладу: dW=±KWWN/W, (4.22) де WN - діапазон шкали приладу; W - значення виміряної величини; КW - клас точності приладу.
Конкретні вирази для розрахунку максимально можливих відносних похибок величин I, U, V0, DT, Cpm наведенні в табл.4.4.
Таблиця 4.3 – Обробка результатів досліду
Таблиця 4.4 – Відносні похибки величин
На основі аналізу похибок вимірювання теплоємності і порівняння дослідного значення теплоємності з табличними слід вказати можливі причини відмінності табличного значення теплоємності і одержаного в результаті виконання лабораторної роботи. 4.6 Контрольні питання
1. З якою метою в технічних розрахунках використовують теплоємність? 2. Що називається теплоємністю? 3. Від чого залежить теплоємність речовини? 4. За якими принципами класифікують теплоємність? 5. Запишіть співвідношення між питомою ізобарною і ізохорною теплоємностями. 6. В чому різниця між істинною і середньою теплоємностями? 7. З яких основних елементів (вузлів і приладів) складається дослідна установка? 8. Для чого служать конкретні прилади і елементи лабораторної установки? 9. За якою формулою визначається теплота, яка підводиться до дослідної речовини? 10. Що називається класом точності приладу (амперметра, вольтметра і т.п.)? 11. Чому ізобарна теплоємність речовини більша ізохорної? 12. За якою формулою визначається абсолютна похибка прямого багаторазового вимірювання величини? 13. За якою формулою визначається відносна похибка прямого багаторазового вимірювання величини? 14. За якою формулою визначається максимально можлива похибка при непрямому вимірюванні величини, що визначається добутком двох дослідних величин? 15. За якою формулою визначається максимально можлива похибка при непрямому вимірювання величини, що визначається різницею двох дослідних величин? 16. За якою формулою здійснюється приведення об’єму ідеального газу до нормальних умов? 17. За яких причин теплота, що підводиться до дослідної речовини, менша теплоти, яка виділяється електронагрівачем?
18. Вкажіть основні методи дослідного визначення теплоємності речовини. 19. За якими формулами визначається масова і об’ємна теплоємність за даними досліду? 20. Які одиниці вимірювання масової, об’ємної і мольної теплоємностей? Лабораторна робота №5 Дроселювання Мета і задачі
В даній лабораторній роботі дослідним шляхом визначаються перепади тиску, об’ємна та масова витрати при дроселюванні потоку повітря на діафрагмі, встановлюється графічна залежність між масовою витратою і перепадом тиску при дроселюванні. В результаті виконання роботи треба засвоїти: - фізичну суть процесу дроселювання; - характер зміни параметрів газу при дроселюванні; - поняття про диференціальний дросель-ефект і його прак-тичне використання. Виконання лабораторної роботи сприяє поглибленню і закріпленню теоретичних знань, розвитку у студентів навиків експериментальних досліджень. Теоретична частина
Процесом дроселювання газу або пари називається незворотний процес зміни їх стану при проходженні через перешкоду (місцеве звуження перерізу каналу) без виконання зовнішньої роботи. Такою перешкодою може бути засувка, заслінка, вентиль, діафрагма і т.п. При проходженні через місцевий опір (звуження) швидкість газу збільшується, а тиск падає. Отриманий перепад тиску, рівний Dp=p1-p2, залежить від природи робочого тіла, його стану, величини співвідношення перерізів звужень і каналу, швидкості руху газу. Процес адіабатного дроселювання - незворотний процес, що протікає в ізольованій системі, в якій до потоку робочого тіла теплота ззовні не підводиться (q=0), а робота розширення газу при різниці тисків Dp=p1-p2 в оточуюче середовище не передається (lтехн=0). Перший закон термодинаміки для потоку можна записати:
або
де h1, h2 - значення питомих ентальпій в перерізах віддалених від місцевого опору, Дж/кг; w1, w2 - швидкість потоку до і після місцевого опору, м/с. Так як до і після дроселювання зміна швидкості потоку незначна і зміною кінетичної енергії можна знехтувати, то з рівняння (5.2) витікає, що: h1 =h2, (5.3) тобто при адіабатному дроселюванні газу або пари ентальпія його до і після дроселювання не змінюється. Процес дроселювання завжди пов’язаний з втратою наявної роботи. Дійсно, при дроселюванні газ не виконує корисної роботи над зовнішнім середовищем, а кінетична енергія газу не змінюється, тому вся робота розширення газу від p1 до p2 і робота p1v1 - p2v2, яку виконує навколишнє середовище при проштовхуванні газу через дросель, використовується на подолання сил тертя. Робота тертя, яка перетворилась в теплоту тертя, супроводжується зростанням ентропії газу. Повна зміна ентропії газу в результаті дроселювання дорівнює:
При дроселюванні ентальпія речовини не змінюється, питомий об’єм збільшується, ентропія зростає. Температура в залежності від умов процесу може зменшуватися, збільшуватися або залишатися незмінною. Так, як для ідеальних газів ентальпія залежить тільки від температури h=h(t), тому при дроселюванні ідеальних газів температура не змінюється T=idem. Для реальних газів, пари і рідин ентальпія залежить від температури і тиску. Зміна ентальпії визначається з диференціальних співвідношень термодинаміки:
В процесі дроселювання dh=0, отже
З формули (5.6) отримаємо вираз для зміни температури реальних газів, пари і рідини:
В процесі дроселювання тиск завжди зменшується, dp<0, теплоємність - завжди величина додатна cP>0. Таким чином, формула (2.8) визначає характер зміни температури. Якщо в рівнянні (2.8) Відношення нескінчено малого приросту температури газу (пари) або рідини до приросту тиску в процесі адіабатного дроселювання називають диференціальним дросельним ефектом. Розрізняють диференціальний і інтегральний дросель-ефекти. Вираз диференціального дросель-ефекту має вигляд:
Кінцевий процес дроселювання характеризується інтегральним дросель-ефектом:
Розмірність диференціального і інтегрального дросель-ефекта - Dh, [К/Па]; [К/МПа]. Температуру T газу (пари) або рідини, при якій
Температура інверсії
Таким чином, на діаграмі стану існують області додатнього і від’ємного дросель-ефекту. При додатньому значенні дросель-ефекту Dh>0 (дроселювання розпочинається від параметрів розміщених всередині кривої інверсії) газ охолоджується, dT<0, а при від’ємному значенні дросель-ефекту Dh<0 (дроселювання розпочинається від параметрів розміщених зовні кривої інверсії) газ нагрівається, dT>0. Величину Dh називають також коефіцієнтом Джоуля-Томсона. Температуру інверсії визначають за рівнянням стану. Для реального газу, який описується рівнянням Ван-дер-Ваальса, температура інверсії може бути знайдена за формулою TІНВ=6,75TКР. Температура інверсії більшості газів, за винятком водню і гелію, достатньо велика і процеси дроселювання протікають із зниженням температури. Процес дроселювання є незворотним. Він супроводжується дисипацією енергії, причому чим більша глибина дроселювання, тим більші втрати роботи, тому, дроселювання парів, газів і рідин в технологічних процесах є не бажане. Властивість газів зменшувати температуру при адіабатному дроселюванні (в області зміни параметрів стану, коли Dh>0) широко застосовуються в різних установках охолодження, включаючи установку зрідження газів, в яких дроселювання є більш економічно вигідним у порівнянні з іншими способами зниження температури. При роботі компресорних станцій газопроводів регулювання витрати газу може здійснюватися як дроселюванням потоку газу, так і зміною швидкості обертання вала компресора. Витратою називається маса чи об’єм газу, що проходить через поперечний переріз трубопроводу за одиницю часу. Одиниці вимірювання витрати G, Q [кг/с];[м3/с]. Між перепадом тиску на дросельному пристрої і масовою витратою робочого тіла існує залежність:
де a - коефіцієнт витрати, який залежить від геометричних розмірів діафрагми і параметрів потоку, і може бути прийнятий рівним 0,29; f - площа поперечного перерізу діафрагми, м2; d - діаметр отвору діафрагми 15 мм; r - густина газу, кг/м3; Dp - перепад тиску на дросельному пристрої, Па.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1588; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.119.199 (0.109 с.) |
 . (4.6)
. (4.6)
 (5.1)
(5.1) , (5.2)
, (5.2) . (5.4)
. (5.4)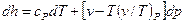 . (5.5)
. (5.5) . (5.6)
. (5.6) . (5.7)
. (5.7) , то dT<0 - температура газу в процесі дроселювання зменшується; при
, то dT<0 - температура газу в процесі дроселювання зменшується; при  , то dT>0 - температура газу в процесі дроселювання збільшується; якщо
, то dT>0 - температура газу в процесі дроселювання збільшується; якщо  , то dT=0 - температура газу в процесі дроселювання не змінюється, що відповідає умові дроселювання ідеального газу.
, то dT=0 - температура газу в процесі дроселювання не змінюється, що відповідає умові дроселювання ідеального газу. . (5.8)
. (5.8) . (5.9)
. (5.9) , називають температурою інверсії. Геометричне місце точок інверсії утворює криву інверсії на діаграмі стану даної речовини. Рівняння кривої інверсії знаходимо з формули (5.7):
, називають температурою інверсії. Геометричне місце точок інверсії утворює криву інверсії на діаграмі стану даної речовини. Рівняння кривої інверсії знаходимо з формули (5.7): . (5.10)
. (5.10) . (5.11)
. (5.11) , (5.12)
, (5.12)


