
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодическая система элементов, строение атома. Химическая связь
При решении вопросов, связанных с электронной структурой атомов, следует исходить из того, что любое устойчивое состояние электрона в атоме характеризуется определенными значениями квантовых чисел n, l, m и s. Состояние электрона в атоме, отвечающее определенным значениям квантовых чисел называется атомной электронной орбиталъю. Атомные орбитали, которым отвечают значения l, равные 0, 1, 2 и 3, называются соответственно s, p, d, f орбиталями. В графических схемах электронного строения атомов каждая орбиталь обозначается символом Согласно принципу Паули, в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая атомная орбиталь может,быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что символически обозначают так: Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по АО, при котором энергия атома минимальна. Поэтому АО заполняются в порядке последовательного возрастания их энергий (при этом не должен нарушаться принцип Паули!). Порядок заполнения электронами АО определяется п р а в и л а м и К л е ч к о в с к о г о, которые учитывают зависимость энергии орбитали от значений как главного (n), так и орбитального (l) квантовых чисел. Согласно этим правилам, АО заполняются электронами в порядке последовательного увеличения суммы п+1 (1-е п р а в и л о К л е ч к о в с к о г о), а при одинаковых значениях этой суммы — в порядке последовательного возрастания главного квантового числа (2-е п р а в и ло К л е ч к о в с к о г о). Пример 1. Какой подуровень заполняется в атоме электронами после заполнения подуровня 4р? Р е ш е н и е. Подуровню 4р отвечает сумма п + 1, равная 4 + 1 = 5. Такой же суммой п + 1 характеризуются подуровни 3d (3 + 2 — 5) и 5s (5 + 0 = 5). Однако состоянию 3d отвечает меньшее значение п(п = 3), чем состоянию 4р; поэтому подуровень 3d будет заполняться раньше, чем подуровень 4р. Следовательно, после заполнения подуровня 4р будет заполняться подуровень 5s, которому отвечает на единицу большее значение п(п = 5). Размещение электронов по АО в пределах одного энергетического подуровня определяется п р а в и л о м Хунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по АО данного подуровня, при котором абсолютное значение суммарного спина атома максимально; при любом другом размещении электронов атом будет находиться в возбужденном состоянии, т. е. будет характеризоваться более высокой энергией.
Пример 2. Составить электронную формулу атома кремния и графическую схему заполнения электронами валентных орбиталей этого атома в нормальном и в возбужденном состояниях. Р е ш е н и е. Составляем электронную формулу атома кремния.
Размещение электронов на 3р-подуровне показано здесь в соответствии с правилом Хунда: суммарный спин атома имеет при этом максимальное значение (1).Другие возможные размещения электронов на 3р-подуровне, например,
отвечают нулевому значению суммарного спина атома и, следовательно, соответствуют возбужденному состоянию атома. При затрате некоторой энергии один из 3s-электронов атома кремния может быть переведен на вакантную Зр-орбиталь; при этом энергия атома возрастает, так что возникающая электронная конфигурация
Электронными аналогами называют элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для всех элементов формулой. В периодической системе элементовэлектронные аналоги входят в состав одной подгруппы. Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением последнего в положительно заряженный ион. Энергию ионизации обычно выражают в электрон-вольтах (эВ)/ Энергию ионизации можно определять, бомбардируя атомы электронами, ускоренными в электрическом поле. Наименьшую разность потенциалов, при которой скорость электрона становится достаточной для ионизации атомов, называют потенциалом ионизации атомов данного элемента. Потенциал ионизации (/), выраженный в вольтах (В), численно равен энергии ионизации (Е), выраженной в электрон-вольтах.
При затрате достаточной энергии можно удалить из атома два, три и более электрона. Первый потенциал ионизации соответствует энергии отрыва первого электрона, второй — энергии отрыва второго электрона и т. д. По мере последовательного отрыва электронов от атома положительный заряд образующегося иона возрастает. Поэтому для удаления каждого последующего электрона требуется большая затрата энергии, так что последовательные потенциалы ионизации атома (I1, I2, I3…) возрастают.
Типы химической связи Описание химической связи в любой молекуле есть, по существу, описание распределения в ней электронной плотности. По характеру этого распределения химические связи традиционно подразделяют на ковалентные, ионные и металлические. Ковалентная связь — химическая связь между двумя атомами, осуществляемая общей для этих атомов парой электронов (Н2, С12 и т. п.). Ионная связь — результат электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками (CsF, NaCl и т. п.). Чисто ионная связь представляет собой лишь предельный случай. В подавляющем большинстве молекул химические связи имеют характер, промежуточный между чисто ковалентными и Чисто ионными связями. Это полярные ковалентные связи, которые осуществляются общей для двух атомов парой электронов, смещенной к ядру одного из атомов-партнеров. Если такое смещение невелико, то связь по своему характеру приближается к чисто ковалентной; чем это смещение больше, тем ближе связь к чисто ионной. Для оценки способности атома данного элемента оттягивать к себе электроны, осуществляющие связь, пользуются значением относительной электроотрицательности (χ)- Чем больше электроотрицательность атома, тем сильнее притягивает он обобществленные электроны. Иными словами, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше разность электроотрицательностей (Δχ) взаимодействующих атомов. Поэтому с ростом Δχ степень ионности связи возрастает. Значения электроотрицательности атомов некоторых элементов по отношению к электроотрицательности фтора, принятой равной 4,0, приведены в таблице.
Пример3 Вычислить разность относительных электроотрицательностей атомов для связей Н — О и О — Э в соединениях Э(ОН)2, где Э — Mg, Ca или Sr, и определить: а) какая из связей Н — О или О — Э характеризуется в каждой молекуле большей степенью ионности; б) каков характер диссоциации этих молекул в водном растворе? Р е ш е н и е. По данным таблицы вычисляем разность электроотрицательностей
Т а к и м о б р а з о м: а) во всех рассмотренных молекулах связь Э — О более полярна, т. е. характеризуется большей степенью ионности; б) диссоциация на ионы в водных растворах будет осуществляться по наиболее ионной связи в соответствии со схемой: соединения будут диссоциировать по типу оснований. Для квантово-механического описания ковалентной связи и строения молекул могут быть применены два подхода: метод валентных связей и метод молекулярных орбиталей. В основе метода валентных связей (ВС) лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами, обладающими противоположно направленными спинами и принадлежащими двум атомам, между которыми осуществляется связь. Такая общая электронная пара может образоваться как в результате спаривания двух неспаренных электронов, принадлежащих разным атомам (обычный механизм образования связи), так и за счет пары электронов одного атома — донора — и вакантной орбитали второго атома — акцептора (донорно-акцепторный механизм образования связи). 2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в таком направлении, при котором это перекрывание максимально. Пример 4. Как изменяется прочность связи Н — Э в ряду Н2О— H2 S — Н2Sе—- Н2 Те? Р е ш е н и е. В указанном ряду размеры валентных электронных облаков элементов (О, S, Se, Те) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т. е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду О — S — Se — Те вследствие увеличения числа промежуточных электронных слоев. Таким образом, при переходе от кислорода к теллуру прочность связи Н — Э уменьшается.
При образовании полярной ковалентной связи смещение общего электронного облака приводит к тому, что плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного атома. В результате первый атом приобретает избыточный отрицательный заряд, а второй — такой же по абсолютной величине избыточный положительный заряд. Подобную систему из двух равных по абсолютной величине и противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга, называют электрическим диполем. Напряженность поля, создаваемая диполем, пропорциональна дипольному моменту молекулы, представляющему собой произведение абсолютного значения заряда электрона q(l,60·10-19 Кл)
на расстояние l между центрами положительного и отрицательного зарядов в диполе: µ = ql. Дипольный момент молекулы служит количественной мерой ее полярности. Дипольные моменты молекул обычно измеряют в дебаях (D).1D = 3,33 10-30 (Кл·м).
Дипольный момент — величина векторная, направленная от положительного конца диполя к отрицательному. Поэтому дипольный момент многоатомной молекулы следует рассматривать как векторную сумму дипольных моментов связей: он зависит не только от полярности каждой связи, но и от взаимного расположения этих связей. Так, молекула АВ2 может иметь линейную (а) или угловую (б) структуру:
Для объяснения геометрической структуры молекул, другими словами, для объяснения направленности ковалентных связей используют представление о гибридизации АО центрального атома. Согласно этому представлению, образованию химических связей может предшествовать изменение валентных орбиталей атома: исходные неравноценные атомные орбитали, как бы «перемешиваясь», образуют энергетически равноценные орбитали. При этом происходит перераспределение электронной плотности, которое требует затраты энергии и в изолированных атомах не реализуется. Но в результате гибридизации электронное облако вытягивается по направлению к взаимодействующему атому, благодаря чему увеличивается его перекрывание с электронными облаками последнего. Это приводит к образованию более прочной химической связи и, следовательно, к выделению дополнительной энергии, которая и компенсирует затраты энергии на гибридизацию. Число гибридных АО равно числу участвующих в гибридизации исходных АО атома. Если в гибридизации участвуют одна s- и jдна р-орбитали (sp- гибридизация), то образуются две равноценные sp-орбитали; из одной s- и двух р-орбиталей (sр2-гибридизация) образуются три sр2-орбитали и т. д. Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодействие между электронами было минимальным, т. е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака ориентируются в противоположных направлениях, при sp2 гибридизации —в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т. е. в направлениях к вершинам правильного треугольника), при зр3-гибридизации — к вершинам тетраэдра (угол между этими направлениями составляет 109°28'). Взаимное расположение осей гибридных электронных облаков при некоторых видах гибридизации показано ниже (каждая стрелка передает направление оси одного из облаков):
Пространственная структура молекулы определяется видом гибридизации валентных орбиталей центрального атома и числом неподеленных электронных пар, содержащихся в его валентном электронном слое. Ионная связь не обладает направленностью и насыщаемостью. В связи с этим у ионных соединений проявляется склонность к ассоциации. Все ионные соединения в твердом состоянии образуют ионные кристаллические решетки, в которых каждый ион окружен несколькими ионами противоположного знака. При этом все связи данного иона с соседними ионами равноценны, так что весь кристалл можно рассматривать как единую молекулу. Свойства ионных соединений вО многом определяются взаимной
поляризацией входящих в их состав ионов. Поляризация иона выражается в относительном смещении ядра и окружающих его электронов внешней электронной оболочки под действием электрического поля соседнего иона; при этом валентные электроны смещаются в сторону катионов. Подобная деформация электронной оболочки ведет к понижению степени ионности связи и к превращению ее в полярную ковалентную связь. Поляризуемость ионов (т. е. их способность деформироваться под действием внешнего электрического поля) характеризуется следующими особенностями: 1. При одинаковом абсолютном значении заряда и равных радиусах ионов поляризуемость анионов больше поляризуемости катионов. 2. Поляризуемость ионов с аналогичным электронным строением возрастает с ростом ионного радиуса (т. е. с увеличением числа электронных слоев). 3. При одном и том же заряде и одинаковом радиусе ионов поляризуемость ионов с 18-электронной оболочкой (например, Сu+, Cd2+) выше, чем ионов с благородногазовой электронной структурой (Na+, Ca2+ и т. п.). Поскольку размеры анионов, как правило, больше размеров катионов, то анионы обладают большей поляризуемостью и меньшей поляризующей способностью, чем катионы. Поэтому при взаимодействии катиона с анионом поляризации подвергается преимущественно анион; поляризацией катиона в большинстве случаев можно пренебречь.
Атом водорода, соединенный с атомом сильно электроотрицательного элемента, способен к образованию еще одной химической связи. Эта связь называется водородной. Наличие водородных связей приводит к заметной полимеризации воды, фтороводорода, многих органических соединений. Например, при невысоких температурах фтороводород — полимер (HF)n, где п может доходить до шести, муравьиная кислота — димер даже в газовой фазе.
Задачи 41 Чему равно число энергетических подуровней для данного энергетического уровня? Каким значением главного квантового числа характеризуется энергетический уровень, если он имеет 4 подуровня? Дайте их буквенное обозначение. 42 Какой элемент имеет в атоме три электрона, для каждого из которых n = 3 и l = 1? Чему равно для них значение магнитного квантового числа? Должны ли они иметь антипараллельные спины? 43 Напишите электронные формулы атомов с порядковыми номерами 18, 63. К какому электронному семейству они относятся? 44 Объясните, пользуясь правилом Клечковского, какие атомные орбитали заполняются раньше: а) 3d или 4р; б) 4f или 5p; в) 5p или 6s; г) 4d или 4f. 45 Укажите порядковый номер элемента у которого: а) заканчивается заполнение электронами 3d-орбитали; б) заканчивается заполнение электронами 4s-орбитали; в) начинается заполнение электронами 4p-орбитали;
46 Сколько неспаренных электронов содержат атомы в невозбужденном состоянии:а) магния; б) алюминия; в) углерода; г) бора; д) серы? 47 Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 39 и 41. Сколько свободных d-орбиталей в атомах этих элементов. 48 Напишите электронные формулы атомов элементов: а) цезия; б) брома; в) ванадия; г) молибдена; д) железа. 49 Атомы, каких элементов имеют следующее строение внешнего и предвнешнего электронного уровня:а) 2s22p63s23p3; б) 3s23p64s2; в) 3s23p64s23d5; г) 4s24p65s04d10. 50 Атомы, каких элементов имеют электронную конфигурацию: 51 Дайте современную формулировку периодического закона. Чем она отличается от той, которая была дана Д.И. Менделеевым? 52 Как учение о строении атома объясняет периодичность в изменении свойств химических элементов? 53 Какой физический смысл имеет порядковый номер и почему химические свойства элемента в конечном счете определяются зарядом ядра его атома? Какая из связей Сa - H, C - Cl, Br - Cl является наиболее полярной и почему? 54 Какой тип гибридизации электронных облаков в молекулах: а) BCl3; б)CaCl2; в) GeCl4; г) SiCl4; Какую пространственную конфигурацию имеют эти молекулы? 56 Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? 57 Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему плавиковая кислота и вода, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? 58 Почему молекула диоксида углерода неполярна, хотя связь углерод - кислород имеет электрический момент диполя 0,37·10-30 Кл-м? 59 Каково взаимное расположение электронных облаков при sp2-гибридизации? Приведите примеры. Какова пространственная структура этих молекул? 60 В каком из перечисленных веществ более выражен ионный характер связи: CCl4, SiO2, CaBr2, NH3?
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 786; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.110.169 (0.047 с.) |
 .
.
 . Валентными орбиталями в этом атоме являются орбитали внешнего (третьего) электронного слоя, т. е. 3s-, Зр- и незаполненные 3d-орбитали. Графически схема заполнения электронами этих орбиталей имеет следующий вид:
. Валентными орбиталями в этом атоме являются орбитали внешнего (третьего) электронного слоя, т. е. 3s-, Зр- и незаполненные 3d-орбитали. Графически схема заполнения электронами этих орбиталей имеет следующий вид:
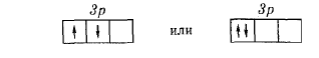
 также соответствует одному из возможных возбужденных состояний кремния:
также соответствует одному из возможных возбужденных состояний кремния: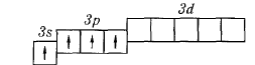

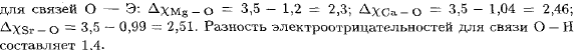
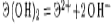 ; следовательно, все рассматриваемые
; следовательно, все рассматриваемые




