
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химически чистые иммуномодуляторы
• Галавит оказывает иммуномодулирующее и противовоспалительное действия. Основные фармакологические эффекты препарата обусловлены влиянием на функциональную активность макрофагов. При гиперактивапии этих клеток галавит обратимо ингибирует образование ими провоспалительных цитокинов. Он стимулирует фа-
гоцитоз, что приводит к повышению неспецифической устойчивости организма к инфекциям. При ослаблении цитотоксических свойств естественных киллеров препарат восстанавливает их до нормальных значений. • Гепон оказывает иммуномодулирующее и противовирусное действия, что проявляется в мобилизации и активации клеток моно-цитарно-макрофагального ряда, повышении резистентности организма к бактериям, грибам и вирусам, индукции синтеза а- и Р-ИФН, подавлении репликации вирусов в клетке, торможении образования провоспалительных цитокинов, стимуляции синтеза AT к Аг инфекционной природы. Перечисленные эффекты гепона особенно выражены у ВИЧ-инфицированных больных, у которых препарат увеличивает содержание CD4 Т-лимфоцитов и NK-клеток в периферической крови, повышает функциональную активность CD8 Т-киллеров, играющих важную роль в защите организма от вирусной инфекции, повышает синтез AT к ВИЧ и возбудителям оппортунистических инфекций. • Полиоксидоний обладает иммуномодулирующими, антиокси-дантными, детоксицирующими и мембранопротективными свойствами.
—Иммуномодулирующее действие препарата заключается в повышении фагоцитарной активности нейтрофилов в отношении Staphylococcus aureus (в том числе у больных хронической грану-лематозной болезнью), нормализации образования провоспалительных цитокинов мононуклеарными клетками периферической крови, повышении цитотоксической активности NK-клеток (особенно при её снижении), активации резидентных макрофагов ретикуло-эндотелиальной системы, что приводит к ускорению элиминации из организма чужеродных частиц, повышении синтеза AT —Детоксицирующие свойства полиоксидония проявляются в его способности снижать в крови концентрацию токсических веществ, например, при ожоговой болезни, остром панкреонек-розе. Это действие связано с высокой молекулярной массой вещества и наличием большого количества активных групп, что способствует адсорбции циркулирующих в крови токсических веществ.
—Антиоксидантные свойства полиоксидония проявляются в захвате активных форм кислорода, торможении процессов ПОЛ. Иммуномодуляторы -0- 531 _- Мембранопротективные свойства полиоксидония проявляются в защите клеток от повреждающего действия ряда токсических веществ. Клиническое применение Применение иммуномодуляторов показано при аллергических и аутоиммунных заболеваниях, иммунодефицитах, а также инфекционных заболеваниях и для иммунореабилитации. • При аллергических заболеваниях целесообразно назначать иммуномодуляторы при наличии сопутствующих признаков вторичного иммунодефицита, например при атопическом дерматите с пиодермией, бронхиальной астме с хроническим обструктивным бронхитом. Применение иммуномодуляторов способствует ликвидации у больного с аллергическим заболеванием очага инфекции (однако иммуномодулирующая терапия не является этиотропной), что может существенно ослабить проявления основного заболевания. В связи с тем, что при аллергических заболеваниях происходит активация Тп2-клеток, наиболее целесообразно назначение препаратов, снижающих активность Th2- и повышающих активность Thl-клеток, однако таких препаратов в настоящее время не существует. • При аутоиммунных заболеваниях в настоящее время для подавления аутоиммунного воспалительного процесса в качестве патогенетической и симптоматической терапии применяют иммунодеп-рессанты, вызывающие быстрый клинический эффект. Однако, например, применение гормональных препаратов при рассеянном склерозе, являющемся Thl-опосредованным заболеванием, эффективно, но оно не увеличивает длительности ремиссии — важного показателя эффективности терапии. В связи с тем, что при многих аутоиммунных заболеваниях нарушено соотношение ТЫ- и Тп2-клеток, а в настоящее время отсутствуют препараты, разрешённые к медицинскому применению при аутоиммунных заболеваниях и способные изменять баланс этих клеток, основанием для применения иммуномодуляторов при аутоиммунных процессах служат инфекционные болезни, осложняющие течение основного заболевания.
• Повышенная восприимчивость к инфекционным заболеваниям — основное проявление первичных и вторичных иммунодефицитов. При первичных иммунодефицитах, связанных с дефектами генети-
ческой программы иммунокомпетентных клеток, применение иммуномодуляторов для повышения антиинфекционной защиты может дать хороший клинический результат. Например, существенное улучшение клинического состояния и показателей иммунного статуса отмечают у больных со снижением содержания всех классов иммуноглобулинов (общая вариабельная иммунологическая недостаточность) при лечении их иммуномодулирующими препаратами, активирующими фагоцитоз, в частности, полиоксидонием. В основном же иммуномодуляторы применяют при вторичных им-мунодефицитах, проявляющихся рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными заболеваниями. Поэтому при наличии в организме хронического инфекционно-вос-палительного процесса можно назначать иммуномодуляторы, даже если иммунологическое обследование не выявило существенных отклонений в иммунном статусе. По мнению авторов, во всех случаях применения противомикробных средств при наличии признаков вторичного иммунодефицита показано назначение и иммуномодуляторов. Таким образом, основное показание для назначения иммуно-модулятора — хронический инфекционно-воспалительный процесс, трудно поддающийся адекватному противомикробному лечению. • При хронических инфекциях иммуномодуляторы следует назначать не после или перед лечением антибиотиками или противовирусными препаратами, а одновременно с ними. В этом случае по возбудителю наносят «двойной удар»: прямое воздействие и косвенное (повышение функциональной активности клеток иммунной системы, что приводит к более эффективной элиминации возбудителя из организма). Предпочтительнее назначение антибиотиков, оказывающих стимулирующее влияние на иммунитет. • Назначение иммуномодуляторов при острых бактериальных и вирусных инфекциях, как правило, не рекомендовано, так как они могут усугубить течение заболевания. Например, при вирусной инфекции, активация Т-киллеров может иметь тяжёлые последствия (вплоть до смертельного исхода) вследствие массивного разрушения клеток, инфицированных вирусом. Это следует учитывать при назначении тимических или бактериальных препаратов, являющихся мощными индукторами провоспалительных цитокинов. Применение иммуномодуляторов при острых инфекционных процессах, особенно бронхов и лёгких, может быть оправдано у иммунологи-чески компрометированных больных, например, относящихся к группе часто и длительно болеющих. Иммуномодуляторы в этих Иммуномодуляторы О- 533 случаях применяют для предупреждения развития постинфекцион-ньіх осложнений. Вследствие наличия у полиоксидония детокси-цируюших и антиоксидантных свойств возможно его применение при острых инфекционных заболеваниях. По мнению авторов, и другие иммуномодуляторы с антиоксидантными и детоксицирую-щими свойствами можно назначать при острых инфекционных процессах у иммунологически компрометированных людей.
• Иммунореабилитация — комплекс медикаментозных и немедикаментозных лечебных мероприятий, направленных на восстановление функциональной активности иммунной системы. Это понятие было впервые сформулировано академиком Р.В. Петровым. По мнению авторов, с этой целью иммуномодуляторы можно применять как в виде монотерапии, так и в комплексе с другими общеукрепляющими средствами у больных с осложнениями (бронхит, ларингит, трахеит и др.) после перенесённого острого инфекционного заболевания; часто и длительно болеющих людей перед началом осенне-зимнего сезона, особенно в экологически неблагоприятных регионах, онкологических больных для улучшения качества жизни. Иммуномодуляторы (например, полиоксидоний) в виде монотерапии применяют для иммунореабилитации онкологических больных. Общие принципы применения иммуномодуляторов у больных с недостаточностью антиинфекционной защиты. 1. Иммуномодуляторы назначают в комплексной терапии одновременно с антибиотиками, противогрибковыми, противопротозой-ными или противовирусными средствами. 2. Целесообразно назначение иммуномодуляторов с первого дня применения химиотерапевтического этиотропиого средства. 3. Иммуномодуляторы, стимулирующие фагоцитоз, можно назначать больным как с выявленными, так и с невыявленными нарушениями иммунитета, то есть основанием для назначения препарата служит клиническая картина заболевания. 4. Применение иммуномодуляторов целесообразно (по возможности) проводить при иммунологическом мониторинге независимо от наличия изменений в иммунной системе. 5. Иммуномодуляторы можно применять в виде монотерапии при проведении иммунореабилитационных мероприятий. 6. Выявление признаков иммунодефицита при иммунологическом обследовании при отсутствии клинических проявлений не служит абсолютным показанием для назначения иммуномодуляторов.
ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА Противовоспалительные лекарственные средства -О- 535 Таблица 25-1. Классификация НПВС по химической структуре
Карбоновые кислоты
производные других химических соединений
Воспаление — один из патологических процессов, характерный для большинства заболеваний. Несмотря на то, что с общебиологической точки зрения воспаление — защитно-приспособительная реакция, в клинической практике его рассматривают как патологический процесс. Противовоспалительные препараты — группа ЛС, применяемых для лечения заболеваний, характеризующихся воспалительным процессом. В зависимости от химического строения и особенностей механизма действия противовоспалительные средства разделяют на следующие группы. 1. Стероидные противовоспалительные препараты, описаны в главе «Гормональные препараты». 2. Нестероидные противовоспалительные средства (НПВС). 3. Базисные, медленно действующие противовоспалительные В данной главе также представлена клиническая фармакология парацетамола, не относящегося к противовоспалительным ЛС, но обладающего обезболивающим и жаропонижающим действиями. НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА НПВС в большинстве своём — производные слабых органических кислот, поэтому они вызывают сходные фармакологические эффекты. Классификация современных НПВС по химической структуре представлена в табл. 25-1. Клиническое значение имеет классификация НПВС, основанная на их селективности в отношении изоформ циклооксигеназы (ЦОГ), представленная в табл. 25-2.
Ибупро-фен Флур- бипро- фен Напрок-сен Кето-профен Таблица 25-2. Классификация НПВС по их селективности в отношении ЦОГ 1 и ЦОГ 2
Неселективные ингибиторы ЦОГ Большинство НПВС
Ацетилсалициловая кислота в малых дозах Механизм действия и основные фармакодинамические эффекты Основные фармакодинамические эффекты НПВС — противовоспалительный, аналгезирующий и жаропонижающий. Ключевой элемент механизма действия НПВС — угнетение синтеза простагландинов, обусловленное торможением активности ЦОГ, основного фермента, участвующего в метаболизме арахидоновой кислоты. • Арахидоновая кислота, образующаяся из мембранных фосфолипи-Дов при участии фосфолипазы А2, — источник как медиаторов воспаления (провоспалительных Пг и ЛТ), так и ряда БАВ, участвующих в физиологических процессах организма (простациклина,
тромбоксана А2, гастропротективных Пг и др.)- Метаболизм ара-хидоновой кислоты происходит двумя путями (рис. 25-1): цикло-оксигеназным (образование Пг, в том числе простациклина и тромбоксана А2при участии ЦОГ) и липооксигеназным (образование ЛТ при участии липооксигеназы). • Простагландины считают основными медиаторами воспаления, так как они сенсибилизируют ноцицепторы к медиаторам воспаления (гистамину, брадикинину), а также понижают порог болевой чувствительности; повышают чувствительность сосудистой стенки к медиаторам воспаления (например, гистамину, серотонину), что приводит к локальному расширению сосудов (покраснению кожи) и увеличению сосудистой проницаемости (отёку); повышают чувствительность гипоталамических центров терморегуляции к действию вторичных пирогенных веществ (ИЛ 1 и др.), синтезированных под влиянием микроорганизмов и их токсинов.
Рис. 25-1. Схема метаболизма простаноидов. ТхА, — тромбоксан А2, ПШ2 ~~ простациклин 12, ПгЕ2 — простагландин Е2, flrF2a — простагландин r2a, 5-НРЕТ — 5-гидроксипероксиэйкозотетраеновая кислота. Противовоспалительные лекарственные средства ♦ 537 В организме обнаружены как минимум два изофермента ЦОГ — ЦОГ 1 и ЦОГ 2 (табл. 25-3). Таблица 25-3. Сравнительная характеристика ЦОГ 1 и ЦОГ 2 (по De Witt D и соавт., 1993)
Параметры Локальная
70кДа
22 кб (11 экзонов)
Увеличение в 2—4 раза
Тромбоциты, эндотели-альные клетки сосудов, желудок, почки и другие ткани
Отсутствует
Синтез простаноидов (простагландинов, простациклина 12, тромбоксана А2), регулирующих физиологические функции организма • ЦОГ 1 экспрессируется в нормальных условиях и ответственна за синтез простаноидов (Пг, простациклина, тромбоксана А2), участвующих в регуляции физиологических функций организма (гастро-протекции, агрегации тромбоцитов, состояния почечного кровотока, тонуса матки, сперматогенеза и др.). • ЦОГ 2 — индуцированная изоформа ЦОГ, участвующая в синтезе провоспалительных Пг. Экспрессию гена ЦОГ 2 стимулируют в мигрирующих и других клетках медиаторы воспаления — цитокины. Анальгетический, жаропонижающий и противовоспалительный эффекты НПВС обусловлены ингибированием ЦОГ 2, тогда как Побочные действия (ульцерогенное, развитие геморрагического син-ДРома, бронхоспазма и др.) обусловлены ингибированием ЦОГ 1. Трёхмерные структуры ЦОГ 1 и ЦОГ 2 сходны, ЦОГ 2 содержит гидрофильный и гидрофобный каналы, а ЦОГ 1 — лишь гидрофобный. ЛС с высокой селективностью в отношении ЦОГ 2 гидро- 538 ♦ Клиническая фармакология -0- Часть II -v- Глава 25 Противовоспалительные лекарственные средства ♦ 539
Другие механизмы противовоспалительного действия НПВС следующие. • НПВС проникают в фосфолипидный бислой мембран иммуноком-петентных клеток и предотвращают клеточную активацию на ранних стадиях воспаления. • НПВС увеличивают содержание внутриклеточного Са2+ в Т-лим-фоцитах, способствующего их пролиферации и синтезу ИЛ 2. • НПВС ингибируют активацию нейтрофилов, воздействуя на G-белок. По убыванию противовоспалительной активности НПВС располагаются в следующем порядке: индометацин > флурбипрофен > диклофенак > пироксикам > кетопрофен > напроксен > фенилбута-зон > ибупрофен > метамизол натрия > ацетилсалициловая кислота. Аналгезирующее действие более выражено, чем противовоспалительное, у препаратов, растворы которых имеют нейтральный рН, поэтому они меньше накапливаются в очаге воспаления, быстрее проникают через ГЭБ и подавляют в ЦНС циклооксигеназы 1 и 2, влияя на таламические центры болевой чувствительности. Аналгезирующее действие НПВС также связано с уменьшением экссудации и ослаблением механического давления на болевые рецепторы в тканях, а также с предупреждением развития гипералгезии. Торможение агрегации тромбоцитов связано с ингибированием синтеза тромбоксана А2. От характера и выраженности этого эффекта зависят индивидуальные особенности НПВС. Так, ацетилсалициловая кислота необратимо ингибирует ЦОГ 1 в тромбоцитах, поэтому при однократном приёме препарата клинически значимое снижение тромбоцитарной агрегации продолжается 48 ч и более, что значительно превышает время выведения препарата из организма. Восстановление агрегационной способности происходит после образования новых тромбоцитов. Однако большинство других НПВС вызывает обратимое ингибирование фермента, поэтому по мере снижения их концентрации в крови агрегационная способность циркулирующих в сосудистом русле тромбоцитов восстанавливается. Умеренное десенсибилизирующее действие связано со следующими механизмами. • Ингибирование синтеза Пг в очаге воспаления и лейкоцитах, что снижает хемотаксическую активность моноцитов.
• Снижение образования гидрогептанотриеновой кислоты, что уменьшает хемотаксическую активность Т-лимфоцитов, эозинофилов и полиморфноядерных нейтрофилов в очаге воспаления. • Торможение бласттрансформации лимфоцитов вследствие блокирования образования Пг. Десенсибилизирующее действие наиболее выражено у индомета-цина, диклофенака и ацетилсалициловой кислоты. фармакокинетика Все НПВС обладают достаточно высокой степенью абсорбции и биодоступности при приёме внутрь (табл. 25-4). Таблица 25-4. Показатели фармакокинетики НПВС ,тттт Доза,._ _ Биоцос- Метабо- „ Элимина- МНН. Абсорбция Т..„ ч г/сут тупность лизм ''2 ция 1 ~ 234567 Ацетилсали- 3—4 80% преиму- Зависит В течение 0,5 80% через кислота верхних от- ции, обыч- часа мета- 60% в неиз- делах тонкой но около болизиру- менённом кишки. 70% пре- ется 90% виде), 20% Зависит от парата препарата через ЖКТ рН среды и лёгкие Фенилбута- 0,6 Около 90% 85-90%, 95% мета- 24 70% через при дли- ется в пе- неизменен- тельном чени ном виде), приёме 30% через ЖКТ в виде метаболитов Индомета- 0,1- 100% 96-98% 80% мета- 4-9 70% через Цин 0,15 при перо- болизиру- почки (20% ральном ется в пе- в неизме-
540 ♦ Клиническая фармакология -Ф- Часть II
Т1/2 большинства НПВС составляет 2-4 ч. Более длительный T,j некоторых препаратов, например фенилбутазона и пироксикама, позволяет назначать их 1—2 раза в сутки. Все НПВС, за исключением ацетилсалициловой кислоты, в значительной степени (90—99%) связываются с белками плазмы крови, что также определяет возможность их взаимодействия с другими ЛС и может привести к повышению концентрации свободных фракций препаратов в плазме крови. НПВС метаболизируются, как правило, в печени, метаболиты эк- скретируются почками. Продукты биотрансформации подавляющего большинства НПВС не обладают фармакологической активностью. Фармакокинетику НПВС описывают двухкамерной моделью, гДе вторая камера — ткани и синовиальная жидкость. Терапевтический Противовоспалительные лекарственные средства ■>> 541 эффект НПВС при заболеваниях суставов в определённой степени связывают со скоростью и степенью их накопления в синовиальной жидкости. Содержание НПВС в суставной жидкости возрастает постепенно; после прекращения приёма препарата в суставе он сохраняется значительно дольше, чем в крови. Прямой корреляции между концентрациями препаратов в крови и синовиальной жидкости не обнаружено. Некоторые НПВС (индометацин, ибупрофен, напроксен) элиминируются из организма на 10-20% в неизменённом виде, в связи с чем состояние выделительной функции почек может существенно изменять их концентрацию в крови и влиять на клинический эффект. Скорость выведения НПВС зависит от дозы препарата и рН мочи. В связи с тем, что многие препараты этой группы — слабые органические кислоты, они быстрее выводятся при щелочной реакции мочи, чем при кислой. Показания В качестве патогенетического средства НПВС показаны при воспалении мягких тканей, опорно-двигательного аппарата, после операций и травм, при неспецифических поражениях миокарда, паренхиматозных органов, аднексите, проктите и др. НПВС также широко применяют для сиптоматической терапии болевого синдрома различного генеза, а также при лихорадочных состояниях. Побочные эффекты и противопоказания Наиболее часто побочные эффекты НПВС развиваются со стороны ЖКТ — гастропатии и желудочно-кишечные расстройства. •При гастропатии, вызванной НПВС, нередко отсутствуют клинические проявления поражения желудка. Первым проявлением гастропатии может быть желудочно-кишечное кровотечение или перфорация. •Желудочно-кишечные расстройства проявляются функциональными нарушениями (тошнотой, рвотой, болями в эпигастральной области, метеоризмом, запорами, диареей), эрозивно-язвенными поражениями желудка и кишечника. Действие НПВС на ЖКТ связано с ингибированием ЦОГ 1 в слизистой оболочке. В результате прекращается синтез гастропротективных Пг, что приводит к уменьшению синтеза слизи, повышению кислотности желудочного содержимого и увеличению проницаемости клеточных мембран. Наи-
более часто эти нежелательные лекарственные реакции отмечают у пациентов из групп риска: длительно принимающих НПВС, при язвенной болезни желудка и двенадцатиперстной кишки или желудочно-кишечных кровотечениях в анамнезе (риск развития осложнений повышается в 14—17 раз), в возрасте старше 60 лет, у принимающих большие дозы НПВС или одновременно получающих лечение глюкокортикоидами или антикоагулянтами, при наличии тяжёлых сопутствующих заболеваниий (например, хронической сердечной недостаточности, сахарного диабета), при злоупотреблении алкоголем. В ряде исследований показано, что частота эро-зивно-язвенных поражений и желудочно-кишечных кровотечений не зависит от лекарственной формы ацетилсалициловой кислоты (в том числе быстрорастворимых, «забуференных», кишечнораст-воримых таблеток), что, вероятно, связано с тем, что желудочно-кишечные расстройства при применении НПВС связаны не с их местным действием на слизистую оболочку желудка и двенадцатиперстной кишки, а с системным действием. Антиагрегантное действие НПВС также способствует возникновению желудочно-кишечных кровотечений. При применении этих ЛС могут возникнуть и другие проявления геморрагического синдрома. Бронхоспазм при применении НПВС наиболее часто развивается у больных с аспириновым вариантом бронхиальной астмы и связан с блокадой ЦОГ 1 в бронхах (в результате преобладания липооксиге-назного пути метаболизма арахидоновой кислоты увеличивается образование ЛТ, оказывающих бронхоспастическое действие). Несмотря на то, что селективные ингибиторы ЦОГ 2 отличаются большей безопасностью, они могут вызвать ОПН, торможение заживления язв желудка, обратимое бесплодие. Опасный побочный эффект производных пиразолона — гемато-токсичность. Актуальность этой проблемы в России обусловлена широким применением метамизола натрия. Более чем в 30 странах применение метамизола натрия резко ограничено или запрещено, что связано с результатами Международного исследования по агранулоцитозу, выявившими, что при применении метамизола натрия риск развития агранулоцитоза возрастает в 16 раз. Агранулоцитоз — прогностически неблагоприятный побочный эффект терапии производными пирозалона, так как у 30-40% пациентов приводит к летальному исходу от вторичных инфекций. Редкое, но прогностически неблагоприятное (летальность может достигать 50%) осложнение применения ацетилсалициловой КИСЛО- Противовоспалительные лекарственные средства -О- 543 ть1 _ синдром Рея (остро развивающаяся тяжёлая энцефалопатия в сочетании с жировой дегенерацией печени и почек). Развитие этого синдрома связано с применением ацетилсалициловой кислоты, как правило, при вирусных инфекциях (например, гриппе, ветряной оспе). Обычно синдром Рея развивается у детей (наиболее часто в возрасте 6 лет). Нарушение функций почек может быть обусловлено как ингиби-рующим влиянием НПВС на синтез сосудорасширяющих Пг, так и их нефротоксическим действием (прямым или иммунным). Факторы риска развития почечных осложнений — сердечная недостаточность, артериальная гипертензия (особенно симптоматические формы, связанные с нарушением функций почек), ХПН, избыточная масса тела. В первые недели приёма НПВС может усугубиться ХПН, что связано с замедлением клубочковой фильтрации. Степень нарушения функций почек варьирует от незначительного повышения уровня креатинина в крови до анурии. Фенилбутазон, метамизол натрия, индометацин, ибупрофен и напроксен могут вызвать интерсти-циальную нефропатию с нефротическим синдромом или без него. В отличие от функциональной почечной недостаточности, органическое поражение почек развивается при длительном приёме НПВС (3-6 мес). После отмены препаратов симптоматика регрессирует с благоприятным исходом. Задержку жидкости и ионов натрия в организме могут вызвать все НПВС, но чаще всего фенилбутазон, индометацин, ацетилсалициловая кислота. Поражение печени при приёме НПВС может быть обусловлено как иммунными процессами, так и токсическим действием НПВС. Им-муноаллергический гепатит наиболее часто развивается в начале курса лечения НПВС; зависимость между дозой препарата и тяжестью клинического проявления отсутствует. Токсический гепатит возникает при длительном приёме препарата и, как правило, сопровождается желтухой. Поражения печени наиболее часто наблюдают при применении диклофенака. Поражения кожи и слизистых оболочек составляют 12-15% всех случаев осложнений при применении НПВС. Обычно кожные проявления возникают на 1-3-й неделе лечения, чаще имеют доброкачественное течение и проявляются сыпями (скарлатино- или коре-яодобными), фотосенсибилизацией (сыпь появляется только на открытых участках тела) либо крапивницей (обычно одновременно с °тёком). Могут возникнуть и более тяжёлые кожные поражения, например полиморфная эритема (при приёме любого НПВС) или пиг- 544 «О- Клиническая фармакология -О* Часть II -Ф- Глава 25 Противовоспалительные лекарственные средства -О* 545
Чрезвычайно редко развиваются анафилактический шок и отёк Квинке (0,01-0,05% всех случаев осложнений). Факторы риска аллергических осложнений — атопический фенотип, аллергические реакции на препараты данной группы в анамнезе. Нарушения функций ЦНС отмечают у 1-6% пациентов, принимающих НПВС (в 10% случаев при приёме индометацина). В основном они проявляются головокружением, головными болями, повышенной утомляемостью и нарушениями сна. Индометацин может вызвать ретинопатию и кератопатию (отложение препарата в сетчатке и роговице). Длительный приём ибупрофена может привести к развитию неврита зрительного нерва. Нарушения психики при приёме НПВС могут проявляться галлюцинациями, спутанностью сознания. Чаще они возникают при приёме индометацина (у 1,5—4% пациентов), что связано с высокой степенью проникновения препарата в ЦНС. Возможно транзиторное снижение остроты слуха при приёме ацетилсалициловой кислоты, индометацина, ибупрофена и производных пиразолона. НПВС обладают тератогенным действием, например приём ацетилсалициловой кислоты в I триместре беременности может привести к расщеплению верхнего нёба у плода (8-14 случаев на 1000 наблюдений). Приём НПВС в последние недели беременности вследствие угнетения синтеза nrF2a может вызвать слабость родовой деятельности, а также преждевременное закрытие артериального протока у плода и гиперплазию сосудов малого круга кровообращения. Реже возникают анемия, лейкопения, тромбоцитопения, агранулоцитоз, нарушения чувствительности, шум в ушах, судороги, выпадение волос, нарушение функций почек и печени. НПВС противопоказаны при индивидуальной непереносимости, язвенной болезни желудка и двенадцатиперстной кишки в стадии обострения, лейкопении, тяжёлом поражении почек, в I триместре беременности, при лактации. Ацетилсалициловая кислота противопоказана детям до 12 лет (до 15 лет с гипертермией на фоне вирусны заболеваний). Лекарственное взаимодействие При проведении фармакотерапии НПВС необходимо учитывать возможность их взаимодействия с другими ЛС, особенно с непрямыми антикоагулянтами, мочегонными, антигипертензивными и другими противовоспалительными препаратами (см. Приложение, табл. 2). НПВС могут значительно снижать эффективность практически всех антигипертензивных ЛС. У больных хронической сердечной недостаточностью НПВС могут увеличить частоту декомпенсаций вследствие ослабления терапевтического действия ингибиторов АПФ и диуретиков. Тактика выбора Эффективность НПВС при воспалительном синдроме оценивают в течение 1-2 нед. Если лечение привело к ожидаемым результатам, его продолжают вплоть до полного исчезновения воспалительных явлений. Чувствительность к НПВС, относящимся даже к одной группе, варьирует в широких пределах. Например, при неэффективности ибупрофена при воспалении и болях в суставах, другое производное пропионовой кислоты — напроксен — может обусловить улучшение. При сопутствующем сахарном диабете (противопоказано назначение глюкокортикоидов) рационально применение ацетилсалициловой кислоты, вызывающей небольшое снижение уровня глюкозы в крови. Производные пиразолона, в частности фенилбутазон, особенно эффективны при анкилозирующем спондилоартрите (болезни Бехтерева), ревматоидном артрите, узловатой эритеме. В более тяжёлых случаях (особенно при ревматических заболеваниях) применяют индометацин, относящийся к наиболее эффективным противовоспалительным препаратам. Однако при приёме индометацина часто возникают побочные эффекты (у 35-50% больных), у 20% обусловливающие необходимость его отмены. Для уменьшения побочных эффектов индометацин назначают на ночь, а днём применяют другие НПВС. Затруднения при выборе НПВС для лечения аутоиммунных заболеваний обусловлены также и тем, что препараты оказывают симптоматическое действие, не влияют на течение ревматоидного артрита и не предотвращают развития деформации суставов. Многие НПВС оказывают выраженное терапевтическое действие, Но одновременно вызывают много нежелательных эффектов, поэтому выбор препарата следует производить с учётом развития прогно-3иРУемых побочных эффектов (табл. 25-5). ■Заказ №213.
Противовоспалительные лекарственные средства <$- 547
Таблица 25-5. Относительный риск возникновения осложнений со стороны ЖКТ при применении НПВС НПВС Ибупрофен
Диклофенак
Кетопрофен
Напроксен
Теноксикам
Нимесулид
Индометацин
Пироксикам Кеторолак *3а 1 принят риск развития осложнений со стороны ЖКТ при применении плацебо.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.255.127 (0.127 с.) |
 530 *v- Клиническая фармакология ♦ Часть II -Ф- Глава 24
530 *v- Клиническая фармакология ♦ Часть II -Ф- Глава 24 532 -О- Клиническая фармакология ♦ Часть II -Ф- Глава 24
532 -О- Клиническая фармакология ♦ Часть II -Ф- Глава 24

 536 -Ф- Клиническая фармакология О Часть II ♦ Глава 25
536 -Ф- Клиническая фармакология О Часть II ♦ Глава 25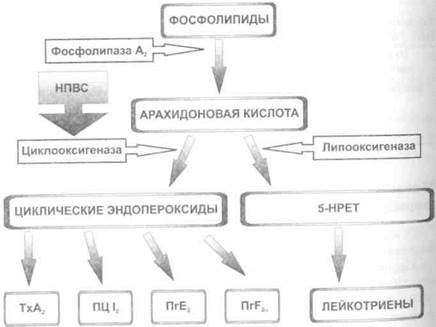
 фильным отделом молекулы связываются с гидрофильным каналом фермента, а гидрофобным — с гидрофобным. Большинство других НПВС, взаимодействуя лишь с гидрофобным каналом, инигибиру-ют как ЦОГ 2, так и ЦОГ 1.
фильным отделом молекулы связываются с гидрофильным каналом фермента, а гидрофобным — с гидрофобным. Большинство других НПВС, взаимодействуя лишь с гидрофобным каналом, инигибиру-ют как ЦОГ 2, так и ЦОГ 1.
 542 -О- Клиническая фармакология -$• Часть II -О* Глава 25
542 -О- Клиническая фармакология -$• Часть II -О* Глава 25 ментная фиксированная эритема (специфична для производных пи-разолона), токсикодермия, пемфигус и усугубление псориаза (при приёме производных энолиновой кислоты). Ибупрофен может вызвать алопецию. При парентеральном применении НПВС могут возникнуть гематомы, при накожном — индурация либо эритемопо-добные реакции.
ментная фиксированная эритема (специфична для производных пи-разолона), токсикодермия, пемфигус и усугубление псориаза (при приёме производных энолиновой кислоты). Ибупрофен может вызвать алопецию. При парентеральном применении НПВС могут возникнуть гематомы, при накожном — индурация либо эритемопо-добные реакции. 546 ♦ Клиническая фармакология О- Часть II
546 ♦ Клиническая фармакология О- Часть II



