
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Під час електролізу однакова кількість електрики виділяє на електродах еквівалентну кількість різних речовин.
Для виділення з розчину електроліту одного еквівалента будь-якої речовини потрібно пропустити через розчин 96500 кулонів електрики. Масу речовини, що виділилася при електролізі, розраховують за формулою: m (x) = (I • t) Еm / F) де m (x) - кількість відновленої чи окисленої речовини (г); I – сила струму, що пропускається, (А); t – час електролізу (с); F – стала Фарадея (96500 Кл/моль); Еm – еквівалентна маса речовини (г/моль) (Еm = M (x)/ n, де M (x) – молярна маса; n – число прийнятих чи відданих електронів). Процес руйнування металів внаслідок хімічної або електрохімічної взаємодії їх з навколишнім середовищем називають корозією. Хімічна або газова корозія зумовлюється взаємодією металів із сухими газами або рідинами, що не проводять електричний струм, і поділяється на атмосферну та виробничу. Оксидні плівки, що при цьому утворюються, часто захищають метал від подальшої корозії або сповільнюють її дію. Існують різні способи захисту металів від корозії, які ґрунтуються на зниженні агресивності корозійного середовища (введення інгібіторів), нанесенні захисних покрить, застосуванні електрохімічних методів. Захисні покриття створюють фарбуванням, оксидуванням, металізацією та пасивуванням. За характером захисної дії металів розрізняють анодне та катодне покриття. У випадку анодного покриття на поверхню менш активного металу наносять активніший метал, який утворює стійку проти корозії захисту плівку (оцинковане залізо). При катодному покритті більш активний метал ізолюється менш активним. Електрохімічна корозія – це руйнування металів у розчинах електролітів з появою у системі електричного струму. Процес виникає внаслідок утворення на поверхні металу величезної кількості гальванічних мікроелементів (гальванічних пар), в яких електродами є метал і його домішки, а електролітом – розчини кислот і солей. Реакції, що супроводжуються зміною ступенів окиснення елементів називають окисно-відновними. У процесі окисно-відновної реакції частина електронів від атомів одного елементу переміщується до атомів іншого елементу. Це означає, що в процесі реакції одні атоми віддають електрони, а інші – їх приймають. У відповідності з хімічною термінологією процес віддачі електронів прийнято називати процесом окиснення, а процес приймання електронів – процесом відновлення. Речовини, що містять атоми, які в процесі реакції віддають електрони, прийнято називати відновниками, а речовини, що містять атоми, які в процесі реакції приймають електрони, прийнято називати окисниками.
а) процеси окиснення
таким чином, при окисненні ступінь окиснення атома-відновника підвищується; б) процеси відновлення:
таким чином, при відновленні ступінь окиснення атома-окисника понижується.
|
|||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 356; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.255.162 (0.004 с.) |
 – 2
– 2 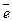 ®
® 
 – 2
– 2  º 2
º 2  – 1
– 1 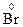 º 2
º 2 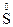 + 2
+ 2  ®
® 



