Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кристалічна гратка — це просторова сітка вузлів, що регулярно повторюються і паралельно розміщуються у просторі і в яких можуть розміщуватися атоми, іони або молекули речовини.
В основі кристалічної гратки лежить елементарна комірка, яка є паралелепіпедом з характерним для даного типу гратки розташуванням атомів (див. рис. 1). Грані цього паралелепіпеда а, Ь, с і кути між ними α, β, γ співпадають з кристалографічними осями даного типу кристалів. Якщо взяти велику кількість елементарних комірок і заповнити ними впритул одна до одної певний об'єм, зберігаючи паралельність граней та ребер, то отримаємо кристал ідеальної будови. В залежності від геометричної форми кристалів або форми елементарної комірки, кутів між її гранями а, β, γ та від співвідношення довжин ребер а, Ь, с розрізняють сім систем (с и н г о н і й) кристалів: кубічну, тетрагональну, ромбічну, моноклінну, триклінну, гексагональну, ромбоедричну. Системи кристалів та їх геометричні характеристики наведені на рис. 3.
Кубічна а=Ь=с α=β=γ=90°
Тетрагональна а=Ь≠с α=β=γ=90'
Ромбічна а≠Ь≠с α=β=90' Моноклінна а≠Ь≠с α=γ=90°β≠90° Tpиклінна а≠Ь≠с α≠β≠γ≠90'
Гексагональна а=в=с α=β=90° γ=1200
Ромбоедрична а=в=с α=β=γ≠90'
Рис.3 Основні системи кристалів
В кубічній системі всі кути елементарної комірки прямі і всі її ребра однакової довжини. Основними формами кубічної системи є куб і октаедр (див. рис. 5). Для кристалів цієї системи існують три решітки: проста, об'ємноцентрована та гранецентрована. В кубічній системі кристалізується значна кількість металів (літій, залізо, мідь), деякі неметали (алмаз, кремній) та багато неорганічних сполук (NaCl, KC1, ZnS). В тетрагональній системі всі кути між ребрами елементарної комірки дорівнюють 90°. Довжини двох ребер елементарної комірки однакові за величиною і утворюють квадрат. Довжина третього не дорівнює довжині двох перших. Основні форми кристалів — квадратна призма та біпіраміда з квадратною основою (див. рис. 5). У цій системі кристалізуються Sn, SnO2 тощо. В гексагональній системі довжини двох ребер кристала однакові, а кути між ними дорівнюють 120°. Третє ребро знаходиться під кутом 90° і його довжина не дорівнює довжинам двох перших. Основні форми кристалів: гексагональна призма та біпіраміда (див. рис. 5). У гексагональній системі кристалізуються деякі метали (Zn, Hg) і сполуки (SiO2, HgS, NaNO3 тощо).
Геометричні характеристики кристалів інших сингоній наведено на рис. 3. Типи кристалічних граток.
В залежності від природи частинок, що містяться у вузлах кристалічної гратки, а також від характеру сил між ними, розрізняють такі основні типи кристалічних граток: іонні, атомні, молекулярні і металічні.
У вузлах іонних граток розміщені іони протилежного знаку, зв'язані силами електростатичного притягання. Зазначимо, що чисто іонний зв'язок в кристалах не реалізується. В іонних сполуках завжди є також ковалентний зв'язок, а частка іонного зв'язку не перевершує 80—90 %. Наприклад, в кристалі NaCI частка іонного зв'язку не перевершує 82%, а в максимально іонній сполуці CsF частка іонного зв'язку становить 93%. В іонних решітках можуть міститися прості іони (кристал NaCI) і складні (кристал NH4NO3).
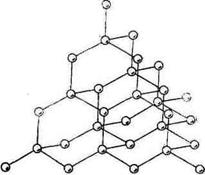
Рис.4.Кристалічна гратка алмазу
Як зазначалось, внаслідок ненасиченості і ненапрямленості іонного зв'язку іонні кристали характеризуються великими координаційними числами. До сполук з іонними гратками належать більшість солей і невелика кількість оксидів. Іонні гратки міцніші за молекулярні, проте слабкіші за атомні. Іонні сполуки характеризуються досить високими температурами плавлення і кипіння; розчини і розплави їх мають високу електропровідність.
У вузлах атомних граток містяться атоми, зв'язані між собою ковалентним зв'язком. До речовин з атомними гратками належать алмаз (рис. 4), кремній, бор і деякі неорганічні сполуки. Будова ковалентних кристалів визначається типом гібридизації орбіталей атомів, які входять до їх складу. Речовини з атомними гратками характеризуються високими температурами плавлення, великою твердістю і практично нерозчинні у жодному з розчинників. У вузлах молекулярних граток розміщені молекули, зв'язані між собою міжмолекулярними силами. До речовин з молекулярними гратками належать неметали (крім вуглецю і кремнію), всі органічні сполуки з неіонним зв'язком і багато неорганічних сполук. У сполуках, які містять атомні групи F—Н, О—Η, Ν—Н, структура кристалів в основному визначається водневим зв'язком. Сполуки з молекулярними гратками мають невелику твердість,.легкоплавкі і леткі.
У вузлах металічних граток містяться атоми металів, між якими вільно рухаються електрони. Для них найхарактерніші такі три типи кристалічних решіток (рис. 5): кубічна гранецентрована а (к.ч. 12), гексагональна б (к.ч. 12) та кубічна об'ємноцентрована в (к. ч. 8). Є речовини, в кристалах яких значну роль відіграють два види взаємодії між складовими частинками. Так, у графіті атоми вуглецю зв'язані між собою в одних напрямках ковалентним зв'язком, а в інших — металічним. Тому гратку графіту можна розглядати і як атомну, і як металічну. У деяких неорганічних сполуках (наприклад, BeO, ZnS. CuCl) зв'язок між частинками, що містяться у вузлах гратки, частково іонний, а частково ковалентний. Тому такі гратки можна розглядати як проміжні між іонними і атомними. Типи кристалічних грат у різних металів різні найбільш часто зустрічаються гратки: об'ємно-центрована кубічна (ОЦК) - а-Fe, Cr, W, гранецентрована кубічна (ГЦК) - г-Fe, А1, Си і гексагональна щильноупакована (ГЩУ) - Mg, Zn і ін. Кристалічна гратка характеризуються певними параметрами, наприклад довжиною ребра куба для ОЦК і ГЦК, яка складає для металів 2,8-6· 10-8 см.
а б в
Рис. 5. Кристалічні гратки металів
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 633; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.83.150 (0.006 с.) |