Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 3. Алифатические углеводороды
(алканы, алкены, алкадиены, алкины) Алканы. Молекулы углеводородов состоят только из атомов углерода и водорода. В предельных углеводородах атомы углерода находятся в состоянии sp3 - гибридизации и связаны с атомами водорода и соседними атомами углерода простой (одинарной) σ-связью. Общая формула гомологического ряда алканов CnH2n+2, гомологическую разность составляет группа –CH2-. Первым в гомологическом ряду стоит метан СН4, за ним следует этан CH3-CH3. Молекула этана содержит два первичных атома углерода. Следующий гомолог - пропан CH3-CH2- CH3, содержит два первичных и один вторичный атом углерода. С увеличением числа атомов углерода в молекуле, начиная с бутана, появляются изомеры - соединения, имеющие одинаковые брутто-формулы, но различные структурные формулы и, следовательно, различные химические свойства. Изомеры линейного строения содержат два первичных атома углерода. Изомеры разветвленного строения имеют в структуре более двух первичных атомов углерода. Алканы – малореакционноспособные вещества. Предельные углеводороды не вступают в реакции присоединения из-за полной насыщенности атомов углерода водородом. Для них характерны реакции замещения. При этом может произойти разрыв связей С - Н либо С - С. В алканах связи С - С и С - Н, обладая незначительной полярностью, при разрыве образуют главным образом не ионы, а радикалы, т.е. разрыв идет в основном по гомолитическому механизму. Предпочтительнее разрыв идет по связи С - Н, в связи с ее большей доступностью для атаки химическими веществами. Важнейшие реакции предельных углеводородов - радикальные реакции (галогенирование, нитрование, сульфохлорирование, крекинг).
Энергия активации радикальных реакций обычно не велика (41,9 – 83,8 кДж/моль), а скорости реакций очень высоки, поэтому при наличии свободных радикалов характерны цепные реакции, в которых исходный радикал вызывает множество дальнейших стадий. Все радикальные реакции включают инициирование (зарождение цепи), рост цепи и заканчиваются обрывом цепи в результате взаимодействия свободных радикалов. Теория цепных реакций была создана советским ученым Н.Н.Семеновым и английским ученым Хиншельвудом, работавшими в тесном контакте (оба ученых удостоены Нобелевской премии).
Рассмотрим цепной радикальный механизм реакции галогенирования на примере реакции хлорирования пропана. Хлорирование пропана протекает избирательно - атомы водорода, связанные с вторичными углеродными атомами, замещаются легче, чем связанные с первичными. I стадия - инициирование или зарождение цепи: hυ С1 • | • С1→ 2С1 • II стадия - рост цепи (развитие цепи):
Предпочтительно образование радикала (1) - вторичного, обладающего наибольшей стабильностью.
Ш стадия - обрыв цепи:
Побочный продукт: CH3-CH2-CH2Cl (1-хлорпропан). Хлорирование метана и его гомологов сопровождается также образованием смеси моно- и полигалогенидов. При нагревании в присутствии катализаторов протекают реакции расщепления алканов (дегидрирование, изомеризация, разложение и др.), а также неполного окисления с образованием кислородсодержащих соединений (спиртов, альдегидов, кетонов и др.). В промышленности предельные углеводороды получают из природных газов и газов нефтепереработки. В лабораторных условиях их можно получить из галогеналкилов, из солей карбоновых кислот (электролизом или сплавлением со щелочью), дегидрированием непредельных углеводородов и восстановлением алкилгалогенидов, спиртов, кетонов и других производных. Алкены или этиленовые углеводороды содержат одну π-связь; атомы углерода находятся в состоянии sp2 -гибридизации. Поскольку вокруг π-связи нет свободного вращения атомов, у алкенов имеется геометрическая цис-,транс-изомерия. По π-связи присоединяется водород, галогены, галогеноводороды, вода, кислоты и др. Если молекула алкена несимметрична, то любое водородосодержащее вещество (Н-Вr, Н-OН, H-CN, H-OSO3H) присоединяется по правилу Марковникова: водород присоединяется к более гидрогенизированному атому углерода.
Следует более подробно рассмотреть условия проведения основных реакций и механизмы радикального и ионного присоединения, а также промышленные (крекинг, пиролиз и др.) и лабораторные способы получения алкенов. Диеновые углеводороды (алкадиены или олефины). Свойства этих соединений определяются, в первую очередь, расположением двойной связи. Алкадиены можно разделить на три группы:
1. С изолированной двойной связью СН2 = СН – СН2 – СН = СН2 Пентадиен -1,4 2. С кумулированной связью (расположенной рядом) СН2 = С = СН2 Аллен 3. С сопряженными связями (двойные связи разделены одной простой связью) СН2 = СН — СН = СН2 Бутадиен - 1,3 (дивинил) Диены с сопряженными связями имеют наибольшее применение — сырье для получения полимеров. Присоединение по двойным связям идет не только в положении 1,2, но и по противоположным концам молекулы – присоединение 1, 4:
Присоединение в 1,2 положения вытекает из общих свойств непредельных соединений. Для объяснения 1,4 присоединения необходимо рассмотреть строение дивинила.
Как видно из схемы: двойные связи в дивиниле длиннее, чем в бутене, одинарная короче обычной – σ-связи и приближается по величине к двойной, т.е. происходит некоторое выравнивание длинн С – С связей. Установлено, что молекула дивинила плоская, атомы расположены в одной плоскости, а 2р орбитали всех четырех атомов углерода расположены в плоскости перпендикулярной первой. Перекрывание электронных облаков происходит не только между С1—С2. и С3-С4 , но и между С2 — С3, хотя оно и меньше, чем в первых случаях. Т.о. молекула дивинила представляет собой сопряженную систему π-электронов; в ней нет «чистых» двойных и одинарных связей, а наблюдается распределение π- электронной плотности по всей молекуле.
Необходимо подчеркнуть, что взаимодействие двух или нескольких соседних π — связей с образованием единого облака π - электронов называется эффектом сопряжения. Сопряжение способствует понижению общей энергии молекулы. Поэтому диены с сопряженными связями довольно устойчивые соединения. Присоединение алкена или алкина в положение 1,4 используется для получения циклических органических соединении:
Диены с сопряженными двойными связями легко полимеризуются в каучукоподобные высокомолекулярные продукты. Цепная полимеризация под влиянием катализаторов (щелочных металлов, металлоорганических соединений) или инициаторов (органические и неорганические перекиси) может происходить также в положении 1,2 —1,2, 1,4 — 1,4 и 1,2—1,4. Аналогично происходит и полимеризация изопрена (2 метилбутандиена - 1,3)
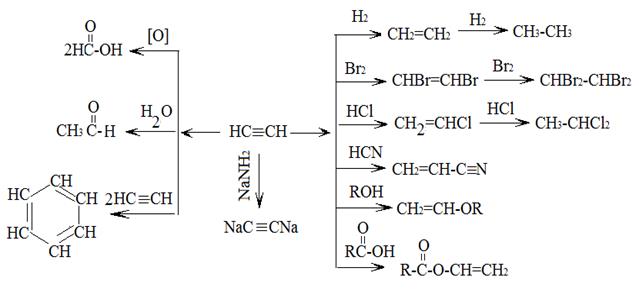
Природный полимер каучук по химическому составу и строению представляет собой стереорегулярный (пространственно упорядоченный) цис-полимер изопрена. Алкины, или ацетиленовые углеводороды, содержат две π-связи. Атомы углерода в них находятся в состоянии sp - гибридизации. Ацетиленовые углеводороды способны присоединять те же вещества, что и этиленовые углеводороды (алкены), но реакции присоединения к алкинам протекают медленнее.
При этом разорваться может одна или две π-связи. В алкинах замещается атом водорода, связанный с атомом углерода при тройной связи. При действии щелочных металлов образуются продукты замещения - ацетилениды металлов. В промышленности широко используют реакции гидратации, полимеризации, конденсации, алкилирования, условия протекания которых следует изучить. Следует обратить внимание на методы получения ацетилена (карбидный, крекинг углеводородов) и гомологов ацетилена.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 549; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.226.105 (0.008 с.) |