
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Будова та класифікація білків
Елементарний аналіз різних білків свідчить, що складовими елементами всіх білків є наступні п’ять:
Через присутність різноманітних функціональних груп білки не можна віднести до якогось певного класу органічних сполук. За хімічним складом білки поділяють на дві групи — прості та складні. За фізіологічними функціями — фібрилярні та глобулярні білки. Із фібрилярних блків побудовані волокна живих тканин. До них відносяться кератин (шкіра, волосся, нігті, роги, пір’я, м’язи). Глобулярні білки підтримують і регулюють життєві процеси. До них належать усі ферменти, гемоглобін — носій кисню у крові, багато гормонів, зокрема інсулін підшлункової залози. Білки мають тривіальні назви, наприклад, гемоглобін, рибонуклеаза, фібриноген та інші. Будова молекул. Складність виділення. Гіпотеза О.Я. Данилевського (1888 р.) — амінокислоти в білках зв’язані амідним зв’язком Кожна білкова молекула має певну будову, яка визначається послідовністю розташування амінокислот у поліпептидних ланцюгах, характерним розміщенням цих ланцюгів у просторі, здатністю створювати молекулярні структури у вигляді глобул або фібрил. Для зручності вивчення будови молекул білка, їх розташування в просторі визначають різні рівні структури білкової молекули: первинну, вторинну, третинну і четвертинну. Первинна структура — це певна послідовність амінокислот у молекулах білків, сполучених між собою ковалентними пептидними зв'язками. Первинна структура стабілізується також дисульфідними зв'язками, якщо вони є в білковій молекулі. Вторинна структура кожної білкової молекули характеризується просторовим розміщенням поліпептидного ланцюга (конформацією молекули). Вторинна структура обумовлена утворенням водневих зв’язків між полярними пептидними групами
На основі рентгеноструктурних досліджень поліпептидів і білків Л. Полінг і Р. Корі встановили, що в складі природних глобулярних білків поліпептидні ланцюги можуть утворювати Ступінь спіралізації поліпептидних ланцюгів білка залежить від його первинної структури. Так, молекули гемоглобіну і міоглобіну спіралізовані на 75 %, альбуміну сироватки крові — на 50 %, пепсину — на 28 %. Крім β-Структура найбільш поширена в білках опорних тканин — колагені (білок сполучної тканини, сухожилля, шкіри), фіброїні (білок шовку), кератині (білок волосся). У багатьох білках одночасно зустрічаються ділянки Третинна структура характеризується розташуванням у просторі спіралізованих поліпептидних ланцюгів з утворенням глобулярних або фібрилярних білкових молекул. Утворення третинної структури обумовлено взаємодією функціональних груп радикалів амінокислот. Четвертинна структура білка — це просторове розміщення кількох білкових поліпептидних ланцюгів, кожний з яких має певні первинну, вторинну і третинну структури. Способи добування білків У зв'язку з широким застосуванням білково-пептидних препаратів у медицині, сільському господарстві, харчовій промисловості проблема штучного синтезу пептидів і білків має велике наукове та практичне значення. Вперше пептидний синтез був здійснений видатним німецьким хіміком Е. Фішером, який в 1901 р. отримав гліцилгліцин, а в 1903 р. запропонував хлорангідридний спосіб утворення пептидів.
Усі методи хімічного синтезу пептидів та білків грунтуються на послідовному здійсненні трьох стадій (Ю. А. Овчинников, 1987): а) блокуванні (захисті) функціональних груп амінокислоти або пептиду, що не беруть участі в реакції утворення пептидного зв'язку; б) конденсації активованої карбоксильної групи одного реакційного компонента з аміногрупою іншого компонента; в) видаленні захисних груп для отримання вільного пептиду (кінцевого продукту) або продовження синтезу. Важливим внеском у проблему штучного синтезу пептидів та білків став запропонований Р. Мерифілдом метод твердофазного синтезу. Головна ідея цього методу полягає в закріпленні поліпептидного ланцюга, що утворюється, на полімерному нерозчинному носії, поверхня якого містить хлорметильні "якірні" групи. За допомогою розробленого методу Р. Мерифілд здійснив синтез пептидів брадикініну, ангіотензину та перший штучний синтез ферментного білка — рибонуклеази. В методі рідкофазового синтезу пептидів (за М. М. Шемякіним, 1965) як носій, на поверхні якого відбувається синтез, застосовують розчинний полістирол, що дає змогу збільшити швидкість реакцій синтезу. Література: [2] с. 133 - 140; [3] с. 475 - 484
ВЛАСТИВОСТІ БІЛКІВ Лекція 16 (1 година) План 1.Фізичні властивості білків 2. Хімічні властивості білків. 3. Значення білків і їх використання. Фізичні властивості білків Агрегатний стан. Природні білкові речовини різноманітні за агрегатним станом: зустрічаються рідкі, напіврідкі, тверді. Та більшість білків, виділених із природних об’єктів, мають вигляд безбарвних аморфних порошків. Розчинність. Білки здебільшого розчинні у воді, кислотах, лугах, але нерозчинні в органічних розчинниках. У розчинах існують у вигляді гідрофільних колоїдів і виявляють багато властивостей колоїдних розчинів. Природні білки оптично активні: вони є лівообертаючими, незалежно від напряму обертання складових амінокислот. Електрофоретична рухливість білків – при наявності заряду на білкових молекулах вони можуть рухатися в електричному полі до протилежно зарядженого полюсу. У кислому середовищі сумарний заряд білкової молекули позитивний, тому вона рухається до катоду (-). У лужному середовищі сумарний заряд білкової молекули негативний, тому вона рухається до аноду(+). При значенні рН, що відповідає ізоелектричній точці, білок не рухається в електричному полі. Високомолекулярність білкових молекул – полімери, які складаються із великої кількості мономерів (α-амінокислот), і мають молекулярну масу від 6000 до декількох мільйонів. Діаліз – переміщення речовин через напівпроникну мембрану, яка пропускає маленькі і затримує великі молекули. Колоїдний характер водних розчинів білка – обумовлюється високомолекулярністю і великим діаметром білкових молекул (> 0,001 мкм; 1 мкм = 10-6м). Протоплазма, яка у великій мірі складається з води і білків, є колоїдною системою. Молекули колоїдного розчину одного білка мають однаковий заряд і тому відштовхуються, не з’єднуються у великі агрегати і не осаджуються. Вони повільно дифундують, не здатні проникати через напівпроникні мембрани, розсіюють світло, мають велику в’язкість. Гелі (драглі) – за певних умов усі колоїдні розчини можуть втрачати текучість і утворювати гелі (драглі). Вони виникають у результаті об’єднання молекул у вигляді сітки, внутрішній простір якої заповнений великою кількістю розчинника, але при цьому розділення на рідку і тверду фази не відбувається, як у випадку коагуляції.
Хімічні властивості білків Амфотерність білків. Гідроліз:
Гідратація і дегідратація (зворотна і незворотна) білків. Гідратація відбувається внаслідок адсорбування полярними групами білків молекул води. Зворотна дегідратація білків - процес втрати води, при якому структура молекул білків не руйнується (приклад - сублімаційна сушка). Незворотна дегідратація супроводжується руйнуванням структури білкових молекул. Осадження (зворотне і незворотне) білків. Зворотне осадження відбувається під дією деяких реагентів: ацетону, етанолу, солей мінеральних кислот тощо. В процесі зворотного осадження після додавання розчинника білки знову переходять в розчин, при цьому їх властивості не змінюються. Незворотне осадження - денатурація, супроводжується під дією різних фізичних і хімічних факторів руйнуванням природної просторової структури білкової молекули: руйнуються четвертинна, третинна і вторинна структури (первинна не змінюється). Під час денатурації розриваються іонні, водневі і дисульфідні зв’язки, поліпептидний ланцюг розкручується і знаходиться або в розгорнутому стані, або у вигляді хаотичного клубка. Денатурація супроводжується зміною фізичних і хімічних властивостей білків: а) зменшується розчинність; б) змінюється форма і розмір молекул; в) втрачається ферментативна активність; г) змінюються оптичні властивості білків і т.д. Незворотне осадження білків в умовах нагрівання називається тепловою денатурацією. Характерні кольорові реакції на білки: - біуретова реакція; - ксантопротеїнова реакція; - реакція на сірку (сульфгідрильна).
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.66.206 (0.01 с.) |
 , який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –
, який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –  . Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51
. Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51 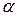 -амінокислота, поліпептидні ланцюги складаються з 21 і 30
-амінокислота, поліпептидні ланцюги складаються з 21 і 30 



