
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретичні умови осадження малорозчинних сполук
Під час аналізу використовують не тільки гомогенні, але й гетерогенні системи. Наприклад, система, яка складається з насиченого розчину, що торкається з осадом відповідної речовини. Окремі частини гетерогенної системи, які розділені поверхнями розподілу, називаються її фазами. Таким чином, осад та насичений розчин ¾ це різні фази гетерогенної системи. Під час виконання аналітичних операцій, таких як, осадження чи відділення іонів, промивання та розчинення осадів, мають справу з гетерогенними системами. Розглянемо малорозчинний електролыт під час його зіткнення з водою. Кристалічна градка барій сульфату утворена барій(ІІ)-катіонами та сульфат-аніонами, які у процесі розчинення під дією диполей води переходять з поверхні кристалів у розчин. Одночасно з процесом розчинення почнеться і зворотній процес ¾ осадження барій сульфату. Поступово швидкість процесу розчинення речовини зменщується, а швидкість протилежного процесу ¾ осадження ¾ збільшується, що призводить до стану динамічної рівноваги. До насиченого розчину, як до рівноважної системи, застосуємо закон діючих мас. Якщо швидкість процесу розчинення
Швидкість протилежного процесу ¾ осадження ¾
У насиченому розчині швидкості обох процесів однакові:
Відношення двох постійних величин Величина ДР кількісно характеризує властивість електроліту розчинятись і називається добутком розчинності. Як би не змінювались концентрації окремих іонів у насиченому розчині малорозчинного електроліту, добуток їх (за умови сталості температури) залишається постійною величиною. У загальному випадку малорозчинний електроліт дисоціює за рівнянням:
Правило добутку розчинності одержує такий матиматичний вираз: де n, m ¾ степені, у які необхідно звести концентрації іонів. Для більш точного розрахунку добутків розчинності слід використовувати не тільки концентарції іонів малорозчинної сполуки, а також їх активності, тому що у розчині електроліту діють міжіонні сили. Якщо враховувати ці сили, то вираз для добутку концентрації барій сульфату буде мати вигляд: ДР(BaSO4)=a(Ba2+)a(SO42-) чи ДР(BaSO4)=[Ba2+]×[SO42-]×f (Ba2+)f(SO42-), де a(Ba2+) та а(SO42-) ¾ активності барій(ІІ)-катіонів та сульфат-аніонів, f (Ba2+) та f(SO42-) ¾ коефіцієнти активності цих іонів. Умови утворення осадів Вплив концентрації іонів Осад малорозчинної сполуки утворюється тільки тоді, коли добуток концентрацій іонів стане більшим за величину її добутку розчинності (за умов певної температури). Вплив кількості осаджувача Для практично повного осадження іону у вигляді сполуки, яка помітно розчиняється у воді, необхідно діяти найлишком осаджуючого реактиву. Встановлено, що при цьому краще брати 1,5 надлишок осаджувача. Вплив комплексоутворення Збільшення розчинності осадів під час додавання великого надлишку осаджувача може бути обумовлено амфотерністю сполук, що утворюються чи утворенням кислих солей. Крім того, надлишок осаджувача визиває сольовий ефект і розчинність осадів збільшується. Вплив розчинності осаджуваної сполуки В однакових умовах осадження іонів бути тим повніше, чим менш розчинним є сполука, у вигляді якої осаджують даний іон. Вплив дисоціації осаджувача Важливе значення має ступінь дисоціації осаджувача, тому що ним визначається концентрація іона-осаджувача у розчині. На повноту осадження може також впливати гідроліз осаджувача. Гідроліз групових реагентів запобігає повному осадженню катіонів. Вплив рН розчину Повне осадження кожної речовини відбувається у певній області концентарції гідроген-іонів. Регулюють рН розчину додаванням кислот, лугів чи буферних сумішей. При цьому луг чи кислоту вибирають таким чином, щоб вони не заважали подальшому відкриттю іонів.
Особливо зручні для регулювання рН раствора буферні суміші. Однак кожна з них має певну буферну ємність, тобто може зв’язувати певну кількість гідроген-іонів та гідроксид-іонів. Тому сильнокислі чи сильнодужні розчини попередньо нейтралізують лугом чи кислотою, після чого застосовують буферну суміш. Інакше її дія не буде ефективною.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.233.43 (0.005 с.) |
 показує кількість барій(ІІ)-катіонів та сульфат-аніонів, що уходять за певний час з поверхні твердої фази у розчин, то швидкість повинна бути прямопропорційна числу цих іонів на одиниці поверхні. Однак, при зменшенні загальної кількості твердої фази розташування іонів на її поверхні залишається незмінним. Тому можна припустити, що швидкість розчинення твердої фази залишається постійною і дорівнює величині k1
показує кількість барій(ІІ)-катіонів та сульфат-аніонів, що уходять за певний час з поверхні твердої фази у розчин, то швидкість повинна бути прямопропорційна числу цих іонів на одиниці поверхні. Однак, при зменшенні загальної кількості твердої фази розташування іонів на її поверхні залишається незмінним. Тому можна припустити, що швидкість розчинення твердої фази залишається постійною і дорівнює величині k1 .
. визначається числом зіткнень барій(ІІ)-катіонів та сульфат-аніонів з одиницею поверхні кристалів барій сульфату за той самий час.
визначається числом зіткнень барій(ІІ)-катіонів та сульфат-аніонів з одиницею поверхні кристалів барій сульфату за той самий час.
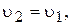


 є величина постійна, яку позначають через ДР(BaSO4):
є величина постійна, яку позначають через ДР(BaSO4): 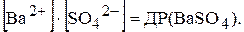


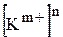 та
та 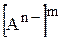 ¾ рівноважні концентрації катіонів та аніонів, що утворюються підчас дисоціації електроліту
¾ рівноважні концентрації катіонів та аніонів, що утворюються підчас дисоціації електроліту  ;
;


