
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Власна провідність провідників.
Розрізняють два види власної провідності провідників: електронну та діркову. Електронна провідність. Від нагрівання кремніє кінетична енергія валентних електронів зростає і окремі зв`язки розриваються, деякі електрони стоють вільними, як у провідниках. В електричному полі вони переміщуються між вузлами рішітки, утворюється електричний струм. Провідність напівпровідників, зумовлену наявністю в них вільних електронів, називають електронною провідністю. Діркова провідність. Коли розривається звязок, то утворюється вакантне місце, де не вистачає електрона. Його називають діркою. У дірці є надлишковий додатній заряд. Положення дірки в кристалі не є незмінним, тому що вільний електрон може зайняти місце дірки, при цьому в місці, звідки перескочив електрон, утворюється нова дірка. Отже дірка може переміщуватися в кристалі. Напрям руху дірок протилежний напряму руху електронів. Провідність напівпровідників, зумовлену переміщенням дірок, називають дірковою провідністю. Домішкова провідність напівпровідників. Донорні домішки.
Якщо внести в кремній миш`як, який є 5-ти валентний, то кількість вільних електронів зростає в багато разів, тому що чотири електрони миш`яку беруть участь у ковалентному звязку з кремнієм, а п`ятий електрон стає вільним. Домішки, які легко віддають електрони і, отже,збільшують кількість електронів, називають донорними домішками (віддаючими). Такі напівпровідники називають напівпровідниками п - типу. В них електрони – основні носії заряду, а дірки – неосновні. Акцепторні дрмішки.
Якщо замість миш`яку використати індій, атоми якого тривалентні, то для встановлення нормальних парноелектронних звязків не вистачаєелектрона. Внаслідок цього утвлрюється дірка. Такі домішки називають акцепторними (приймаючими). Напівпровідники із акцепторними домішками називають напівпровідниками р – типу. Вних дірки є основними носіями заряду, а електрони – неосновними. Р – п перехід Візьмемо напівпровідник, права частина якого містить донорні домішки (тобто є напівпровідником п – типу), а ліва – акцепторні домішки (провідник р – типу). Контакт двох напівпровідників різних типів називають п – р-переходом.
При утворенні контакту електрони частково переходять з напівпровідників п – типу в провідник р – типу, а дірки в зворотньому напрямі.
В результаті напівпровідник п – типу заряджається додатньо, а провідник р – типу - від`ємно. Дифузія припиняється після того, як електричне поле, що виникає в зоні переходу, перешкоджає дальшому переміщенню електронів і дірок. Увімкнено напівпровідник з р – п-переходом в електричне коло. Спочатку приєднаємо батарею так, щоб потенціал напівпровідника р – типу був додатнім, а напівпровідника п – типу – від`ємним. При цьому стру через р – п -перехід передаватиметься основними носіями: з ділянки п у дідянку р – електронами, а з ділянки р у ділянку п – дірками.
Внаслідок цього провідність буде великою, а опір – малим. Такий перехід називають прямим. Вольт-амперна характеристика зображена на малюнку прямою лінією. Перемкнемо полюси батареї. Тоді при такій самій різниці потенціалів струм у колі буде значно меншим, ніж при прямому переході. Це зумовлено тим, що електрони через контакт перейдуть з ділянки р у ділянку п, а дірки – з ділянки п у ділянку р. Але в напівпровіднику р – типу мало вільних електронів, а в напівпровіднику п – типу мало дірок. Тепер через контакт переходять неосновні носії, а їх мало. Внаслідок цього провідність зразка буде малою, а опір великим. Утворюється так званий запірний шар. Цей перехід називається зворотним. Волт-амперну характеристику зворотного переходу зображено на малюнку пунктирною лінією.
16. Електричний струм у газах. Іонізація, рекомбінація
Типи самостійних розрядів: тліючий; дуговий; коронний; іскровий. Іонізація Матеріал з Вікіпедії — вільної енциклопедії. Перейти до: навігація, пошук Іонізація (йонізація) — утворення електрично заряджених частинок — вільних електронів та йонів з електрично нейтральних частинок середовища. Може здійснюватися шляхом відриву від атому, що входить до складу молекулярної частинки, одного або декількох електронів з утворенням йона або за рахунок переходу електрона (електронів) від однієї частинки до іншої з набуттям ними зарядів.
Ступінь іонізації — відношення числа йонів до числа нейтральних частинок в одиниці об’єму. Енергія, необхідна для відриву електрона, називається енергією іонізації. Потенціал іонізації — фізична величина, що визначається відношенням енергії, необхідної для одноразової іонізації атома (молекули), до заряду електрона; характеризує міцність зв’язку електрона. Іонізація в електролітах відбувається в результаті розчинення при розпаді молекул розчиненої речовини на йони (електролітична дисоціація); Іонізація в газах — в результаті відриву від атома або молекули одного або декількох електронів під впливом зовнішніх чинників; Іонізація в твердих тілах — в результаті переходу електронів з валентної зони або з домішкових рівнів в зону провідності. Йонізація викликається дією світла (фотоіонізація), електронним ударом (ударна іонізація), тепловим рухом (термоіонізація), дією електричного поля та ін. Рекомбінація (Молізація) — возз'єднання різноманітних йонів у нейтральні молекули. Стосовно до електронів і йонів у газовому розряді процес рекомбінації протилежний процесу іонізації. Стосовно різнознакових іонів у електролітах процес рекомбінації протилежний дисоціації. Стосовно електронів провідності й дірок у напівпровідниках процес рекомбінації протилежний утворенню електрон-діркових пар. Стосовно вакансій та міжвузлових атомів процес рекомбінації протилежний утворенню пар Френкеля. 17. Явище електролізу. Закон Фарадея для електролізу Електро́ліз – розклад речовин (напр., води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом. Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються. В результаті електролізу на електродах виділяються речовини в кількостях, пропорційних кількості пропущеного струму. Електроліз застосовується для одержання багатьох речовин (металів, водню, хлору та ін.), при гальваностегії (нанесенні металічних покриттів), гальванопластиці (відтворенні форми предметів), а також у хімічному аналізі (полярографія). Первый закон Фарадея В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит: Второй закон Фарадея Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты. Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где Второй закон Фарадея записывается в следующем виде:
где
18. Дія магнітного поля на провідник зі струмом. Сила Ампера
|
|||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 996; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.234.62 (0.01 с.) |







 называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
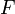 — постоянная Фарадея.
— постоянная Фарадея.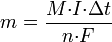
 — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза,
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза,  — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав),
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), 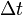 — время, в течение которого проводился электролиз,
— время, в течение которого проводился электролиз,  — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).


