
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристики некоторых индикаторов ⇐ ПредыдущаяСтр 3 из 3
Рассмотрим следующие случаи титрования. Титрование сильной кислоты сильным основанием HCl + NaOH ® NaCl + H2O H+ + OH- ® H2O В точке эквивалентности образуется соль сильной кислоты и сильного основания, которая не подвергается гидролизу. Реакция среды будет нейтральной (рН=7). В данном случае индикатором может служить лакмус.
Титрование слабой кислоты сильным основанием CH3COOH + NaOH ® CH3COONa + H2O CH3COOH + OH- ® CH3COO- + H2O Образующаяся соль слабой кислоты и сильного основания в растворе подвергается гидролизу: CH3COO- + HOH ® CH3COOH + OH- Точка эквивалентности в этом случае будет находиться в щелочной среде, поэтому следует применять индикатор, меняющий окраску при рН>7, например, фенолфталеин.
Титрование слабого основания сильной кислотой NH4OH + HCl ® NH4Cl + H2O NH4OH + H+ ® NH4+ + H2O Образующаяся соль в растворе подвергается гидролизу: NH4+ + HOH ® NH4OH + H+ Точка эквивалентности будет находиться в кислой среде, поэтому можно применять метилоранж. ОБРАЗЕЦ оформления лабораторной работы в Титриметрическом анализе Лабораторная работа №... Дата “Название лабораторной работы” Первичный стандарт - СЭ(NaOH) = …………моль/л Определяемое вещество (титрант) - СЭ(HCl) =?, T(HCl) =? Индикатор - метилоранж Условия титрования - (рН среды, нагревание и т.д.) Уравнение реакции (в молекулярной и ионно-молекулярной формах): Результаты эксперимента заносятся в таблицу:
V ср. (HCl) = Вычисления:
ПРИГОТОВЛЕНИЕ И СТАНДАРТИЗАЦИЯ РАСТВОРОВ ТИТРАНТОВ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
1. Приготовление и стандартизация 0,1 М HCl С помощью ареометра определите плотность выданного Вам концентрированного раствора соляной кислоты (допустим, что r = 1,179 г/мл). По таблице плотности растворов (приложение табл. 3) найдите массовую долю кислоты в этом растворе (w = 36%). Рассчитайте какой объем 36% раствора HCl Вам нужно взять для приготовления 250 мл 0,1 моль/л раствора.
Молярная масса эквивалента HCl равна 36,46 г/моль, поэтому в 250 мл 0,1 моль/л раствора должно содержаться 0,912 г безводной HCl: m (HCl) = MЭ · СЭ · V = 36,46 · 0,1 · 0,25 = 0,912 г Масса 36% раствора HCl, содержащая это количество кислоты, равна:
Объем исходного раствора кислоты можно найти по формуле:
Отмерьте маленьким мерным цилиндром рассчитанный объем (» 2,0 мл)36% раствора соляной кислоты и перелейте в большой цилиндр. Доведите объем раствора до 250 мл дистиллированной водой, слейте его в склянку на 250 мл и перемешайте. 1.2 Приготовление раствора первичного стандартного вещества Тетраборат натрия и HCl реагируют между собой следующим образом Na2B4O7 + 2НСl +5H2O ® 2NaСl +4Н3BO3 Фактор эквивалентности Na2B4O7 в данной реакции равен 1/2, М(1/2 Na2B407×10H2O) = 190,686 г/моль. Для приготовления 100 мл 0,1М 1/2 Na2B4O7 необходимо взять m = C×V×M = 0,1×0,1×190,686 = 1,9 г Na2B407×10H2O. Вначале с помощью ручных весов отвешивают около 1,9 г Na2B407×10H2O. Массу взятой навески затем уточняют с помощью аналитических весов и растворяют её примерно в 50 мл горячей воды в мерной колбе вместимостью 100 мл. После охлаждения раствор доводят водой, имеющей температуру окружающей среды, до метки и перемешивают. Рассчитывают точную концентрацию тетрабората натрия в растворе
где m - масса навески декагидрата тетрабората натрия, измеренная с помощью аналитических весов. 1.3. Титрование раствора первичного стандартного вещества стандартизируемым раствором HCl В 3 колбы для титрования отмеривают пипеткой по 10,00 мл раствора тетрабората натрия, добавляют в каждую колбу по 2 капли 1% раствора метилового оранжевого и титруют приготовленным раствором HCl. Титрование проводят до того момента, когда чисто жёлтая окраска раствора приобретёт оранжевый оттенок. Для сравнения можно взять 10 мл дистиллированной воды и добавить к ней такое же, как и к анализируемому раствору, количество индикатора. Титрование проводят до появления различия в окрасках обоих растворов. Молярная концентрация HCl в растворе равна
где
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.121.170 (0.006 с.) |

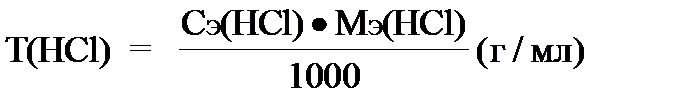


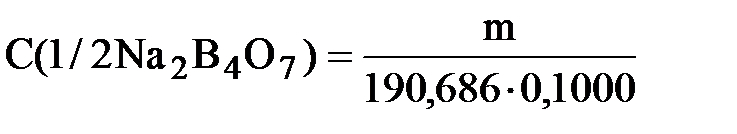 ,
, ,
,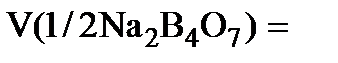 10,00 мл,
10,00 мл,  - среднее значение объёма (мл) раствора HCl, затраченного для титрования.
- среднее значение объёма (мл) раствора HCl, затраченного для титрования.


