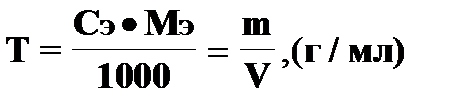Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисления в титриметрическом анализе
Для выражения концентрации растворов в этом методе анализа обычно используют молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальность) - это количество вещества эквивалента, которое содержится в 1 литре раствора. М олярная концентрация эквивалента обозначается СЭ (допускается N), и рассчитывается по формуле: СЭ= nэ/V, где nэ - количество вещества эквивалента, моль; V - объем раствора, л единица измерения концентрации - моль/л. Количество вещества эквивалента (nэ) того или иного вещества в заданном объеме равно: nэ = m/Mэ = Сэ·V, где m - масса вещества, г; MЭ - молярная масса эквивалента, г/моль,V - объем раствора, л. Таким образом, при титровании в точке эквивалентности количество вещества эквивалента титрованного раствора равно количеству вещества эквивалента определяемого вещества - закон эквивалентов: nэ(A) = nэ(B) или Сэ(А) · V(А) = Сэ(В) · V(В), отсюда Кроме молярной концентрации эквивалента концентрацию выражают титром (Т). Титр - это количество граммов растворенного вещества, содержащегося в 1 мл раствора. Титр и молярная концентрация эквивалента раствора связаны формулой:
Титр по определяемому веществу - это количество граммов определяемого вещества, которое реагирует с 1 мл титранта.
Приемы титрования Прямое титрование - это простейший прием титрования, заключающийся в том, что к определенному объему раствора определяемого вещества (А) по каплям приливают титрант (рабочий раствор) вещества (В). Зная концентрацию и объем рабочего раствора (В), израсходованного на реакцию с определяемым веществом (А), можно легко вычислить концентрацию последнего:
Если основная реакция идет медленно, или нет подходящего индикатора для фиксирования точки эквивалентности, особенно при работе с неустойчивыми веществами, то применяют обратное или заместительное титрование. Обратное титрование - это процесс титрования, при котором к определенному объему раствора определяемого вещества (А) приливают точно известный объем титранта (В1), взятого в избытке. Избыток, не вошедшего в реакцию вещества (В1), оттитровывают раствором другого титранта (В2) точно известной концентрации. Расчеты производят по формулам:
nэ(A) = nэ(B1) - nэ(B2);
Титрование заместителя. Сущность этого метода заключается в том, что к определяемому веществу (А) прибавляют вспомогательное вещество (Р), реагирующее с ним с выделением эквивалентного количества нового вещества (А1), которое оттитровывают соответствующим титрантом (В). Другими словами, вместо непосредственного титрования определяемого вещества (А) титруют его заместитель (А1). Так как количества А и А1 эквивалентны, то количество вещества эквивалента определяемого вещества nэ(А) равно количеству вещества эквивалента титранта nэ(В):
nэ(A) = nэ(А1) = nэ(B); МЕТОД НЕЙТРАЛИЗАЦИИ В основе метода лежит реакциявзаимодействия ионов водорода или ионов гидроксония с гидроксид-ионами, которая приводит к образованию слабодиссоциированных молекул воды: H+ + OH- ® H2O или H3O+ + OH- ® 2 H2O Этим методом можно определять концентрацию и количество кислот, оснований, солей, водные растворы которых подвергаются гидролизу, а также смеси этих веществ. Основными титрантами (рабочими растворами) метода нейтрализации являются растворы сильных кислот (HCl или H2SO4) и сильных оснований (NaOH или KOH). В качестве установочных веществ (или первичных стандартов) для установления титра (стандартизации) кислот используют тетраборат натрия Na2B4O7.10 H2O или карбонат натрия Na2CO3, для стандартизации щелочей используют щавелевую кислоту H2C2O4.2H2O или янтарную кислоту H2C4H4O4. Для определения точки эквивалентности в методе нейтрализации применяют кислотно-основные индикаторы (см. табл.). Это сложные органические кислоты или основания, которые изменяют свою окраску в зависимости от рН раствора. Интервал рН, в котором индикатор меняет цвет, называется интервалом перехода окраски индикатора. Значение рН, при котором заканчивают титрование с данным индикатором, называется показателем титрования индикатора (рТ). Величина рТ находится внутри интервала перехода окраски индикатора. При подборе индикатора пользуются следующим правилом: рН в точке эквивалентности должен совпадать с рТ индикатора или находиться внутри интервала перехода окраски индикатора. Точка эквивалентности не всегда совпадает с рТ индикатора, что приводит к ошибке титрования, которая называется индикаторной ошибкой.
Таблица
|
||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 813; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.8.34 (0.016 с.) |